Contenidos en este artículo
Si eres nuevo en el sector farmacéutico o nunca has trabajado con el término Validación de Procesos vamos a comenzar con una serie de definiciones para que sea mucho más claro y fácil de entender el tema que vamos a tratar.
En un mundo en constante evolución y crecimiento, la validación de procesos se ha convertido en una herramienta esencial para garantizar la calidad, eficiencia y vida del producto en diferentes sectores industriales. Ya sea en la industria farmacéutica, alimentaria, manufacturera, tecnológica, entre otras, la un proceso validado es fundamental para garantizar productos de calidad.
En este blog, exploraremos la importancia de las validaciones de procesos, gestión de calidad, sus principales objetivos, y cómo llevar a cabo una validación exitosa.
“En la industria farmacéutica, la precisión no es solo una meta, es una necesidad, y ahí es donde la validación de procesos juega un papel crucial.”
Raúl Quevedo
COO Cercal Group
¿Qué es la validación de procesos farmacéuticos?
Según el reporte técnico 937 Geneva 2006 de la OMS un proceso se valida con evidencia documentada que proporciona un alto grado de seguridad sobre el proceso que se hace sobre un producto asegurando su calidad
La validación de procesos farmacéuticos es un conjunto de actividades que se llevan a cabo para asegurar que un proceso de fabricación de medicamentos es repetible, controlado y consistente, garantizando así que los productos finales cumplan con los requisitos de calidad y seguridad establecidos por las agencias reguladoras.
Este proceso se basa en la aplicación de protocolos y pruebas rigurosas a cada etapa de la producción, desde la selección de materias primas hasta el control de calidad del producto final. Su objetivo es reducir al mínimo los riesgos asociados con la fabricación de medicamentos, garantizando la calidad y eficacia de los mismos en todo momento.
Fases del Proceso de validación
La validación de procesos es un parámetro crítico en la industria, ya que asegura que los productos farmacéuticos se fabriquen de manera consistente y cumplan con los requisitos de calidad y seguridad establecidos por las agencias reguladoras. La validación de procesos se divide en varias fases, que incluyen:
- Planificación y preparación: En esta fase, se establece un plan de validación que detalla los objetivos, alcance, metodología, responsabilidades y criterios de aceptación. También se identifican los procesos y equipos críticos que requieren validación.
- Evaluación de datos y selección de proveedores: Es importante evaluar y seleccionar cuidadosamente a los proveedores de materias primas y equipos para garantizar la calidad y el cumplimiento de los requisitos.
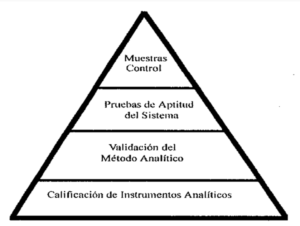
- Calificación de equipos e instalaciones (IQ, OQ, PQ): La calificación es un proceso formal que garantiza que los equipos e instalaciones funcionen correctamente y cumplan con los requisitos especificados. Se divide en tres etapas:a) Calificación de instalación (IQ): Se verifica que las instalaciones y equipos se instalen correctamente y cumplan con las especificaciones. b) Calificación operacional (OQ): Se confirma que los equipos e instalaciones funcionan correctamente dentro de los rangos operativos especificados. c) Calificación de desempeño (PQ): Se demuestra que los equipos e instalaciones pueden funcionar de manera consistente y reproducible bajo condiciones de producción reales.
- Validación del proceso: Se valida el proceso de fabricación completo para asegurar que el producto final cumpla con los requisitos de calidad y seguridad establecidos. La validación del proceso generalmente incluye tres lotes de producción consecutivos y se realiza mediante la ejecución de protocolos y análisis estadístico de los datos obtenidos.
- Validación de sistemas de soporte: Se validan los sistemas de soporte críticos, como el sistema de purificación de agua, sistemas de aire acondicionado y sistemas de control de calidad, para garantizar que no afecten negativamente la calidad del producto.
- Validación de métodos analíticos: Los métodos analíticos utilizados para evaluar la calidad del producto, como pruebas de potencia, impurezas y estabilidad, también deben ser validados para garantizar la confiabilidad y precisión de los resultados.
- Monitoreo y control continuo: Después de la validación, es fundamental monitorear y controlar continuamente los procesos y equipos para garantizar la calidad del producto y la eficiencia del proceso. Esto puede incluir la implementación de controles estadísticos de proceso y la realización de auditorías internas y externas.
- Revalidación: La revalidación se lleva a cabo periódicamente o cuando se producen cambios significativos en los procesos, equipos, materias primas o especificaciones del producto. Esto garantiza que los cambios no afecten negativamente la calidad del producto.
Tipos de Validación
Existen validaciones de diferentes tipos y cada una está dispuesta para un momento específico del proceso (Antes, durante y después) :
- Validación prospectiva (Antes): Se lleva a cabo durante la etapa de desarrollo en que se realiza un análisis de riesgo de cada etapa del proceso, el cual se divide en pasos individuales, que son luego evaluados basándose en la experiencia pasada a fin de determinar qué pasos pueden llevar a situaciones críticas.
- Validación concurrente (Durante): Se lleva a cabo durante la manufactura de rutina de un producto a comercializar.
- Validación retrospectiva (Después): Involucra la evaluación de experiencias pasadas a través de la documentación de producción, bajo la condición de que la composición, procedimientos y equipos permanezcan sin cambios.
Una buena práctica para la mejora continua en la industria farmacéutica
Para priorizar la calidad, el proceso de validación no termina después de la retrospectiva, sino al contrario continua con una revalidación. Es un conjunto de actividades llevadas a cabo para garantizar que un proceso de producción de medicamentos sigue siendo eficiente, consistente y de calidad después de cambios en la maquinaria, equipos, formulaciones, materias primas, métodos de producción, personal o entorno de fabricación. La revalidación es esencial para mantener la conformidad con las Buenas Prácticas de Fabricación (GMP) y garantizar la seguridad y eficacia de los productos farmacéuticos.
Existe también una práctica relacionada con la validación, y como tal es un proceso previo conocido como la calificación. En una calificación se comprueba y documenta que los equipos instalados cumplan con la función específica y sin errores para la que fueron instalados, cabe aclarar que el proceso de calificación por sí solo no puede ser tomado como una validación.
Relación entre calificación y validación
La relación entre validación y calificación en el contexto de las GMP es esencial para asegurar la eficacia y calidad del producto final.
La validación y calificación son procesos complementarios dentro de las GMP, y ambos contribuyen a garantizar que los productos sean fabricados de manera consistente y segura, cumpliendo con los requisitos de calidad establecidos.
- Validación: La validación es el proceso mediante el cual se demuestra, mediante datos objetivos, que un sistema, proceso o método es capaz de producir resultados consistentes y reproducibles, cumpliendo con las especificaciones y requisitos de calidad predefinidos. La validación asegura que el proceso de fabricación es robusto y que el producto final cumple con los estándares de calidad establecidos.
Existen diferentes tipos de validación en el marco de las GMP, como la validación de procesos, de limpieza, de métodos analíticos y de sistemas computarizados, entre otros.
- Calificación del proceso: es el proceso mediante el cual se verifica que los equipos, sistemas e instalaciones utilizadas en la fabricación de un producto funcionan de acuerdo con las especificaciones y requisitos establecidos. La calificación es un componente esencial de la validación, ya que un equipo o sistema no calificado puede afectar la calidad y consistencia del producto final.
Ambos procesos hacen parte de las buenas prácticas de manufactura (GMP), y es la calificación la que se pone en marcha primero con la calificación de especificaciones de diseño del proceso. Seguido de esto vendrían dos calificaciones más: instalación y operación. Ahí es cuando entra en acción la validación del proceso o calificación de desempeño, el resultado de esta actividad dará cuenta de lo que se esté haciendo correctamente y los errores actuales; además, con estos datos viene un control para el cambio que busca mejorar estos procesos para así volver a iniciar con la calificación de los equipos nuevamente generando un ciclo de vida y de mejora continua.
Esta relación se puede trabajar en un nivel más profundo reconociendo que la naturaleza documental de esta práctica donde se puede ver cuales son los componentes de calidad de los datos:
Requisitos para un estudio de validación de procesos
Es importante entender que un estudio de validación de proceso es una evaluación sistemática y documentada que se lleva a cabo para demostrar que un proceso específico es capaz de producir consistentemente un producto o resultado que cumple con los requisitos de calidad preestablecidos.
Para cumplir con los parámetros críticos de forma óptima es necesario cumplir con una serie de atributos de calidad preestablecidos relacionados con el personal, la documentación, equipos, instrumentos e instalaciones.
- Personal: El personal debe conocer para qué se realiza la validación del proceso, cuál es su participación, y cómo se realizará. Se debe contar con el registro del proceso de capacitación.
- Equipos, Instrumentos e Instalaciones: esta área se requiere de la calibración de cada uno de los ítems, adicional de la documentación que dé prueba de ello, de igual manera, se requiere de un programa de mantención para los anteriormente mencionados.
- Documentación: La documentación para las validaciones es una herramienta clave. Este proceso comienza por el plan maestro de validaciones, seguido del protocolo de validación de procesos y por último el informe de validación de procesos. También, hay varios documentos necesarios para la validación como son los relacionados con las buenas prácticas de manufactura donde se tiene que tener en cuenta las normativas vigentes y actualizadas.
Otro ítem clave es la documentación relacionada con el proceso de fabricación del productode calidad, todos estos documentos se utilizan para asegurar la trazabilidad en el proceso y evitar errores de seguridad.
Para el protocolo de validaciones se tiene que dejar cada elemento claramente definido recordemos que el objetivo de la validación es demostrar la consistencia de los procesos de producción que se están realizando. Por último hay una documentación anexa con datos muy valiosos que se deben entregar, un análisis estadístico intra-lote, Tablas datos crudos por etapa y por prueba, estadística descriptiva, Histogramas, Cartas de control.
Marco regulatorio y normativo
Como mencionamos al inicio de este blog, la mejor referencia normativa es el reporte técnico 937 Geneva 2006 de la OMS, que hace parte del Anexo 4 OMS: Guías suplementarias en buenas prácticas de manufactura, cuadragésimo reporte de validación. y el Anexo 3 OMS de la guía de buenas prácticas de manufactura que ofrece otra guía para el proceso de validación.
- Annex 4: Supplementary guidelines on good manufacturing practices: Validation.Fortieth report. World Healt Organization Geneva. Who technical report series 937 Geneva 2006.
- Annex 3:Good manufacturing practice: guidelines on validation
- PIC´S(VALIDATION MASTER PLAN INSTALLATION AND OPERATIONAL, QUALIFICATION, NON-STERILE PROCESS VALIDATION, CLEANING VALIDATION)
Soluciones en Validaciones y Calificaciones con Cercal
Entendiendo la criticidad de este proceso Cercal propone soluciones integrales para tu empresa. En el apartado de certificaciones garantizamos la seguridad de varios de tus equipos y sistemas. Como lo son las salas limpias, integridad de filtros de aire, campanas de extracción y muchos más. Al final del proceso entregamos la documentación necesaria para que puedas tomar las decisiones correctas.
También validamos y garantizamos sistemas computarizados, cadenas de frío y equipos críticos de laboratorio, tenemos los ojos puestos en mejorar la calidad de la industria desde sus procesos por eso te invitamos a que trabajes con nosotros para cumplir este objetivo.
“La validación de procesos es el corazón de la calidad farmacéutica, asegurando que cada medicamento producido sea seguro y efectivo para el paciente.”
Claudia Velasco
CEO Cercal Group
Conclusión
La validación de procesos en la industria farmacéutica es un pilar fundamental para garantizar la seguridad y eficacia de los medicamentos.
Este procedimiento meticuloso asegura que cada etapa de la producción cumpla con los estándares de calidad más altos. La implementación de la validación de procesos no solo mejora la confiabilidad del producto final. Sino que también minimiza los riesgos asociados con la fabricación de medicamentos.
Es un proceso integral que abarca desde la selección de materias primas hasta el control de calidad del producto terminado.
Cada fase de la validación, incluyendo la planificación, calificación de equipos, y validación de métodos analíticos, es crucial. La validación prospectiva, concurrente y retrospectiva juega un papel vital en el ciclo de vida del producto.
Estas etapas permiten identificar y mitigar riesgos potenciales, asegurando así la consistencia y eficiencia del proceso de fabricación. La revalidación periódica es igualmente importante, especialmente cuando se introducen cambios en los procesos o materiales.
El enfoque proactivo en la validación de procesos refleja el compromiso de la industria con la mejora continua. Este enfoque no solo cumple con las regulaciones vigentes, sino que también establece un estándar de excelencia en la fabricación farmacéutica.
La validación de procesos, no es solo una obligación regulatoria, sino una estrategia esencial para mantener la confianza y seguridad en los productos farmacéuticos.
En conclusión, la validación de procesos es la piedra angular en la industria farmacéutica. Siendo esencial para asegurar productos de alta calidad y proteger la salud pública.