Contenidos en este artículo
La validación de limpieza es un componente esencial en la industria farmacéutica, garantizando que los equipos y superficies que entran en contacto con productos estén libres de contaminantes. Esta práctica no solo asegura la calidad del producto final, sino que también protege la salud del consumidor. A medida que la industria ha evolucionado, también lo ha hecho la importancia y la metodología detrás de la validación de limpieza, convirtiéndola en un pilar de la producción farmacéutica.
¿Qué es la validación de limpieza y por qué es crucial?
La validación de limpieza es el proceso mediante el cual se verifica y confirma que los equipos y superficies utilizados en la producción farmacéutica están adecuadamente limpios y libres de residuos o contaminantes. Es crucial porque cualquier residuo o contaminante puede afectar la calidad, eficacia y seguridad del producto final. Además, la contaminación cruzada, especialmente en la producción de medicamentos, puede tener graves consecuencias para la salud del consumidor. Por lo tanto, la validación de limpieza no solo garantiza la integridad del producto, sino que también cumple con las regulaciones y normativas establecidas por entidades reguladoras, asegurando la confianza del consumidor en los productos farmacéuticos.
Breve historia y evolución de la validación de limpieza en la industria farmacéutica.
La validación de limpieza ha recorrido un largo camino desde sus inicios. En los primeros días de la industria farmacéutica, la limpieza se basaba principalmente en la observación visual. Sin embargo, con el tiempo y el avance de la tecnología, se reconoció la necesidad de métodos más precisos y cuantificables. En las últimas décadas, con el aumento de la conciencia sobre la seguridad del paciente y la calidad del producto, la validación de limpieza ha ganado prominencia.
Las regulaciones se han vuelto más estrictas, y las empresas farmacéuticas han adoptado técnicas avanzadas, como métodos analíticos sensibles, para garantizar la ausencia de contaminantes. Además, la introducción de guías como la ICH Q3 y la PDA TR 29 (Technical Report No. 29), han integrado la validación de limpieza en un enfoque más amplio de garantía de calidad. Por lo tanto, la evolución de la validación de limpieza refleja el compromiso continuo de la industria con la excelencia y la seguridad.
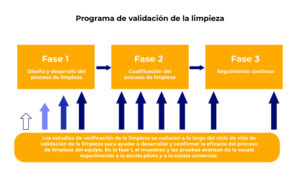
Proceso de validación de limpieza: De lo básico a lo complejo
La validación de limpieza es un proceso meticuloso que garantiza la integridad de los productos farmacéuticos. Desde establecer criterios claros hasta la implementación de métodos de muestreo y análisis, cada paso es esencial para asegurar que los equipos y superficies estén libres de contaminantes. A medida que la industria ha avanzado, este proceso ha evolucionado, incorporando técnicas más sofisticadas y precisas. A continuación, explicaremos los fundamentos de la validación de limpieza, desde la definición de criterios hasta el análisis detallado de contaminantes.
Definición de criterios de limpieza
Antes de embarcarse en el proceso de validación, es esencial definir qué se considera “limpio”. Estos criterios pueden basarse en:
- Ausencia de residuos visibles: La primera línea de defensa, donde no deben observarse contaminantes a simple vista.
- Niveles aceptables de microorganismos: Estableciendo un umbral para la cantidad permitida de microorganismos.
- Concentración de un residuo específico: Determinando límites aceptables para residuos químicos o de productos anteriores.
Estos criterios sirven como base para los siguientes pasos del proceso y aseguran que se cumplan las expectativas de limpieza.
Métodos de muestreo: Directos e indirectos
El muestreo es esencial para evaluar la eficacia de la limpieza. Los métodos se dividen en:
- Directos: Como el uso de hisopos, donde se toma una muestra directamente de la superficie o equipo.
- Indirectos: Como el enjuague con soluciones, donde se recoge y analiza la solución de enjuague para detectar contaminantes.
La elección del método depende de la naturaleza del equipo, el producto y los criterios de limpieza establecidos.
Análisis y detección de contaminantes
Una vez tomadas las muestras, es vital analizarlas para detectar contaminantes. Los métodos incluyen:
- Espectroscopía: Para detectar y cuantificar residuos químicos.
- Microbiología: Para identificar y contar microorganismos.
- Cromatografía: Utilizada para separar y analizar componentes de una muestra.
- Técnicas de titulación: Para determinar la concentración de sustancias específicas.
Estos análisis proporcionan una visión detallada de la eficacia de los procedimientos de limpieza y garantizan que se cumplan los criterios establecidos.
ICH Q3 y PDA TR 29: Impurezas y validación de limpieza en farmacéutica
Las pautas ICH (International Council for Harmonisation) buscan armonizar regulaciones farmacéuticas en Europa, Japón y EE.UU. ICH Q3 se centra en las impurezas de estos productos. Aunque no aborda la validación de limpieza directamente, es vital para comprender el marco regulatorio:
- Q3A: Impurezas en nuevos productos farmacéuticos.
- Q3B: Impurezas en derivados de productos naturales.
- Q3C: Guías para residuos de solventes.
- Q3D: Impurezas elementales.
Q3A: Impurezas en nuevos productos farmacéuticos
Las impurezas en nuevos productos farmacéuticos se refieren a sustancias no deseadas que están presentes en el medicamento final pero que no son el ingrediente activo. Estas impurezas pueden surgir durante el proceso de producción, almacenamiento o a través de la degradación del producto. Es esencial identificar y cuantificar estas impurezas para garantizar la seguridad y eficacia del medicamento. Las agencias reguladoras, como la FDA o la EMA, establecen límites estrictos para estas impurezas y requieren pruebas exhaustivas antes de aprobar un nuevo medicamento. La presencia de impurezas puede afectar la calidad, seguridad y eficacia del producto farmacéutico.
Q3B: Impurezas en derivados de productos naturales
Los productos naturales, como plantas medicinales o extractos animales, han sido utilizados tradicionalmente para tratar diversas enfermedades. Sin embargo, al derivar productos de estas fuentes naturales, pueden introducirse impurezas. Estas impurezas pueden ser residuos de pesticidas, metales pesados, contaminantes microbiológicos, entre otros. Es crucial identificar y eliminar estas impurezas para garantizar que los derivados de productos naturales sean seguros para el consumo. Además, debido a la complejidad de los productos naturales, la identificación y cuantificación de impurezas puede ser un desafío, requiriendo técnicas analíticas avanzadas.
Q3C: Guías para residuos de solventes
Los solventes son sustancias utilizadas en la fabricación de productos farmacéuticos para extraer, purificar o sintetizar ingredientes activos. Sin embargo, después de su uso, pueden quedar residuos de estos solventes en el producto final. Estos residuos pueden ser tóxicos y representar un riesgo para la salud. Por ello, existen guías y regulaciones que establecen límites máximos permitidos de residuos de solventes en medicamentos. Estas guías, emitidas por organismos internacionales como la ICH o la OMS, proporcionan métodos para detectar y cuantificar residuos de solventes y garantizar que los niveles estén dentro de los límites seguros.
Q3D: Impurezas elementales
Las impurezas elementales se refieren a la presencia de elementos químicos no deseados en un producto farmacéutico, como metales pesados (plomo, mercurio, cadmio, entre otros). Estos elementos pueden ser tóxicos y dañinos para la salud humana. Pueden introducirse en el medicamento a través de materias primas contaminadas, equipos de procesamiento o envases. Es esencial detectar y limitar la presencia de estas impurezas elementales para garantizar la seguridad del medicamento. Las agencias reguladoras establecen límites estrictos para estas impurezas y requieren pruebas rigurosas para asegurar que los medicamentos no contengan niveles dañinos de impurezas elementales.
PDA TR 29: Validación de Limpieza en Producción Farmacéutica
El PDA TR 29, emitido por la Parenteral Drug Association, es un informe técnico esencial que proporciona directrices sobre la validación de procesos de limpieza en la industria farmacéutica. Esta guía se centra en garantizar que los equipos y herramientas utilizados en la producción de medicamentos estén adecuadamente limpios y libres de residuos que puedan comprometer la calidad y seguridad del producto final. El informe destaca la importancia de establecer límites aceptables para los residuos, garantizando que no haya contaminación cruzada entre lotes. Además, el PDA TR 29 orienta sobre la selección de métodos de muestreo adecuados y cómo validar los métodos analíticos utilizados para detectar impurezas. En resumen, este informe técnico es una herramienta vital para las empresas farmacéuticas que buscan asegurar la integridad de sus procesos de limpieza y, en última instancia, la seguridad de sus medicamentos.
Otras guías relacionadas con validación de limpieza
La ICH Q9, conocida como “Gestión de Riesgos de Calidad”, es una guía desarrollada por la Conferencia Internacional de Armonización que proporciona un marco para la gestión de riesgos en la industria farmacéutica. Su relación con la validación de limpieza es directa, ya que ambos buscan garantizar la calidad y seguridad de los productos farmacéuticos, evitando posibles contaminaciones y riesgos asociados.
La ICH Q9 se aplica en la validación de limpieza al proporcionar un marco para identificar y evaluar riesgos como la contaminación cruzada, residuos de productos anteriores y la presencia de agentes de limpieza. A través de la identificación de estos riesgos, las empresas pueden implementar medidas de control adecuadas, como procedimientos de limpieza específicos y pruebas analíticas. Además, la guía enfatiza la importancia de la revisión y mejora continua, asegurando que los procesos de validación de limpieza se mantengan actualizados y efectivos.
Desafíos y soluciones en la validación de limpieza
La validación de limpieza en la industria farmacéutica enfrenta múltiples desafíos, desde la variabilidad de equipos y productos hasta la falta de estándares universales. Sin embargo, con la evolución tecnológica y la investigación constante, se han desarrollado soluciones innovadoras que abordan estos retos, garantizando la calidad y seguridad de los productos.
Retos comunes en la validación de limpieza de equipos
- Diversidad de equipos y productos: Cada equipo y producto puede requerir un proceso de limpieza diferente.
- Falta de estándares universales: No existe un único método o criterio de limpieza manual aceptado globalmente.
- Detección de contaminantes a niveles bajos: Los residuos pueden estar presentes en cantidades mínimas, difíciles de detectar.
- Tiempo y coste: La validación exhaustiva puede ser costosa y consumir mucho tiempo.
- Cambios en las regulaciones: Las regulaciones pueden cambiar, requiriendo adaptaciones en los procesos de validación.
Innovaciones y tecnologías emergentes en la validación de limpieza
La industria ha visto un auge en tecnologías y métodos innovadores para abordar los desafíos de la validación de limpieza. Las técnicas de espectroscopía avanzada, por ejemplo, permiten detectar residuos a niveles extremadamente bajos. Además, la inteligencia artificial y el aprendizaje automático están siendo implementados para predecir y optimizar los procedimientos de limpieza. Los sistemas automatizados, por otro lado, garantizan los protocolos de limpieza uniformes y reducen la variabilidad humana. También se están desarrollando sensores en tiempo real que monitorean la presencia de contaminantes durante el procedimiento de limpieza. Estas innovaciones no solo mejoran la eficiencia y precisión de la validación de limpieza, sino que también aseguran que la industria esté preparada para enfrentar desafíos futuros.
Conclusión: El futuro de la validación de limpieza en la industria farmacéutica
La industria farmacéutica está en constante evolución, y con ella, la validación de limpieza. Las tendencias actuales apuntan hacia una mayor automatización, precisión y enfoque en la gestión o evaluación de riesgos. Las técnicas avanzadas de espectroscopía, la inteligencia artificial y los sensores en tiempo real son solo algunas de las innovaciones que están redefiniendo la forma en que se lleva a cabo la validación de limpieza.
Mantenerse actualizado en las mejores prácticas de validación es más crucial que nunca. Con regulaciones más estrictas y una creciente conciencia sobre la seguridad del paciente, las empresas farmacéuticas deben asegurarse de que sus procesos de limpieza aplicados sean robustos, eficientes y, sobre todo, efectivos. La adopción de las últimas tecnologías y metodologías no solo garantiza la calidad del producto, sino que también fortalece la confianza del consumidor en los medicamentos que consume.
En Cercal Group, entendemos la importancia de la validación de limpieza en la industria alimentaria y farmacéutica. Nos especializamos en la validación de procesos y facilidad de limpieza del equipo, con un enfoque particular en el cumplimiento de las pautas ICH Q3, Q8, Q9 y Q10. Desde la evaluación de procedimientos existentes hasta la capacitación en Buenas Prácticas de Fabricación, nuestro equipo está comprometido con la excelencia. Si buscas garantizar la calidad y seguridad de tus productos, Cercal Group es tu aliado ideal. No dudes en contactarnos para más información; estamos aquí para servirte y guiarte en cada paso del camino.
Preguntas frecuentes sobre la validación de limpieza
La validación de limpieza es un tema esencial en la industria alimentaria y farmacéutica. Con ello, surgen numerosas preguntas sobre su implementación, eficacia y regulaciones. A continuación, abordamos algunas de las consultas más comunes en este ámbito.
¿Cómo se determina la eficacia de un proceso de limpieza requerido?
La eficacia de un proceso de limpieza adecuado se determina a través de una combinación de evaluaciones visuales, pruebas analíticas y criterios preestablecidos. Primero, se define qué se considera “limpio”, ya sea basándose en la ausencia de residuos visibles, niveles aceptables de microorganismos o concentraciones específicas de residuos. Luego, se toman muestras de las superficies o equipos sucios, utilizando métodos directos o indirectos. Estas muestras se analizan en laboratorios para detectar la presencia de contaminantes. Si los resultados cumplen con los criterios definidos, se considera que el proceso de limpieza adecuadas es eficaz.
¿Con qué frecuencia debe realizarse la revalidación?
La frecuencia de revalidación depende de varios factores, como cambios en los procesos, equipos o productos, y los resultados de auditorías anteriores. En general, se recomienda realizar una revalidación periódicamente o cuando haya cambios significativos que puedan afectar la eficacia del procedimiento de limpieza eficaz. Además, si se detectan problemas o deficiencias en una validación anterior, puede ser necesario realizar una revalidación más pronto. Es esencial mantener un registro de todas las validaciones y revalidaciones para garantizar la continuidad y la calidad del proceso.
¿Qué regulaciones y normativas deben seguirse en la validación de limpieza?
La validación de limpieza debe cumplir con las regulaciones y normativas establecidas por entidades reguladoras en cada país o región. En el ámbito internacional, la Conferencia Internacional de Armonización (ICH) proporciona guías, como la ICH Q3 y la PDA TR 29 (Technical Report No. 29). Además, organismos como la FDA (Administración de Alimentos y Medicamentos de EE. UU.) y la EMA (Agencia Europea de Medicamentos) tienen guías específicas sobre la validación de limpieza. Es crucial que las empresas farmacéuticas estén al tanto de estas regulaciones y las implementen adecuadamente para garantizar la producción segura de medicamentos y cumplir con los estándares de calidad.