Contenidos en este artículo
Las Buenas Prácticas de Fabricación (BPF) son un conjunto de directrices que proporcionan el marco operativo para garantizar que los medicamentos sean de alta calidad y seguros para el consumo. Estas directrices son reconocidas internacionalmente y adoptadas por las industrias farmacéuticas para garantizar la coherencia en la producción y control de medicamentos. Recientemente, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) de Argentina ha emitido una nueva normativa, la ANMAT 4159/2023, que introduce cambios significativos en las BPF.
Esta nueva normativa incorpora avances científicos y tecnológicos, adoptando nuevos requerimientos internacionales, como los aprobados por la Pharmaceutical Inspection Cooperation Scheme (PIC’S) PE 009-16 Parte I y II del 2022, y la norma de International Council for Harmonisation ICH Q7A. Este cambio es un reflejo de la constante evolución de la ciencia y la tecnología, más la necesidad de mantener las BPF al día con estos avances en garantía de calidad.
La normativa ANMAT 4159/2023 representa un paso importante en la mejora continua de las Buenas Prácticas de Fabricación y tiene implicaciones significativas para los fabricantes de medicamentos. Te invitamos a seguir leyendo este artículo para conocer más detalles sobre estos cambios y su impacto en la industria farmacéutica.
Buenas Prácticas de Fabricación: Un Estándar Internacional
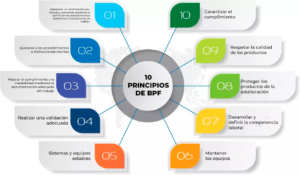
Las Buenas Prácticas de Fabricación (BPF) representan un estándar internacional que guía la producción y control de medicamentos para garantizar su calidad y seguridad. Este conjunto de directrices es reconocido y adoptado globalmente, proporcionando un marco operativo que asegura la coherencia y la excelencia en la industria farmacéutica.
Las BPF abarcan todos los aspectos de la producción, desde los materiales iniciales, las instalaciones y el equipo, hasta la formación y la higiene del personal. Estas directrices ayudan a minimizar los riesgos involucrados en la producción farmacéutica que no pueden eliminarse mediante el control de productos químicos finales.
Además, las BPF no son estáticas. Evolucionan y se adaptan a los avances científicos y tecnológicos, así como a las nuevas normas y regulaciones internacionales. Esto asegura que sigan siendo relevantes y efectivas en un entorno de producción de materias primas en constante cambio.
La nueva Normativa ANMAT 4159/2023 es un ejemplo de cómo las BPF pueden adaptarse y evolucionar. Esta normativa incorpora nuevos requerimientos internacionales, reflejando los avances recientes en la ciencia y la tecnología farmacéutica. Además, pone un énfasis particular en la gestión del riesgo, proporcionando a las empresas las herramientas necesarias para identificar, evaluar y controlar los riesgos en sus procesos de fabricación.
Las BPF son, por lo tanto, más que un conjunto de directrices. Son un estándar internacional que asegura la calidad de materias primas y la seguridad de los medicamentos, un marco que guía la producción farmacéutica y un sistema que se adapta y evoluciona con el tiempo. La adopción y el cumplimiento de las BPF son fundamentales para cualquier empresa que busque producir medicamentos seguros y eficaces.
La nueva normativa ANMAT 4159/2023 y su impacto en las Buenas Prácticas de Fabricación
La nueva normativa ANMAT 4159/2023 marca un hito en la evolución de las Buenas Prácticas de Fabricación. Este nuevo reglamento no solo refuerza los estándares existentes, sino que también incorpora una serie de innovaciones y actualizaciones que reflejan los avances recientes en la ciencia y la tecnología farmacéutica.
Durante el blog veremos uno de los aspectos más destacados de la ANMAT 4159/2023. El cual es la adopción de nuevos requerimientos internacionales: Pharmaceutical Inspection Cooperation Scheme (PIC’S) PE 009-16 Parte I y II del 2022, y la norma de International Council for Harmonisation ICH Q7A. Estos requerimientos representan las mejores prácticas actuales en la fabricación de medicamentos.
Además, la normativa pone un énfasis particular en la gestión del riesgo. Este enfoque, basado en la norma ICHQ9, proporciona a las empresas las herramientas necesarias para definir y generar los procedimientos que deben cumplir en materias primas. También ofrece un mecanismo para defender sus prácticas ante las autoridades de condiciones sanitarias. Este enfoque en la gestión del riesgo es esencial para garantizar la seguridad alimentaria y la eficacia de los medicamentos producidos.
La ANMAT 4159/2023 también tiene implicaciones para los procesos biotecnológicos. La inclusión de estos procesos en la normativa refleja la creciente importancia de la biotecnología en la industria farmacéutica y asegura que estos procesos se realicen de acuerdo con las Buenas Prácticas de Fabricación.
Además, esta normativa tiene un impacto significativo en varios organismos. Entre ellos, varias cámaras de especialidades medicinales y la Confederación Médica de la República Argentina. Por lo que deben adaptarse a las nuevas regulaciones y asegurarse de que cumplen con los estándares actualizados.
Esta normativa es, por lo tanto, un paso importante hacia la mejora de las Buenas Prácticas de Fabricación. Su adopción asegura poder estar al día con los avances internacionales y continuar garantizando la seguridad alimentaria y la eficacia de los medicamentos producidos.
Adopción de nuevos requerimientos internacionales
La adopción de nuevos requerimientos internacionales es una de las características más destacadas de la normativa ANMAT 4159/2023. Esta actualización refleja la necesidad de adaptarse a los avances en ciencias y de mantener las Buenas Prácticas de Fabricación en línea con los estándares globales.
Como se ha mencionado, los nuevos requerimientos adoptados en la normativa provienen de fuentes reconocidas a nivel mundial como la Pharmaceutical Inspection Cooperation Scheme (PIC’S) PE 009-16 Parte I y II del 2022. Un organismo internacional que se dedica a promover la cooperación y la armonización en la inspección y la calidad de los medicamentos. Donde sus directrices son ampliamente reconocidas, respetadas en la industria farmacéutica y en el proceso de producción.
Por otro lado, la normativa también adopta la norma de International Council for Harmonisation ICH Q7A. Este documento es un referente en la industria, ya que proporciona directrices claras y detalladas sobre las Buenas Prácticas de Fabricación para ingredientes farmacéuticos activos.
Estos nuevos requerimientos internacionales no solo refuerzan los estándares de calidad y seguridad en la fabricación de medicamentos, sino que también introducen conceptos y prácticas novedosas en cuanto a los riesgos de contaminación. Por ejemplo, se pone un énfasis particular en la gestión del riesgo, proporcionando a las empresas las herramientas necesarias para identificar, evaluar y controlar los riesgos en el proceso de fabricación.
El enfoque en la gestión del riesgo en las Buenas Prácticas de Fabricación
La gestión del riesgo es un componente esencial de las Buenas Prácticas de Fabricación (BPF), y la ANMAT 4159/2023 pone un énfasis particular en este aspecto. Este enfoque se basa en la norma ICHQ9, que proporciona una guía detallada sobre cómo implementar la gestión de riesgos inherentes en la producción farmacéutica.
La gestión del riesgo en las BPF implica la identificación sistemática de los riesgos asociados con la producción de medicamentos, la evaluación en términos de su probabilidad y gravedad, y la implementación de medidas para controlarlos y minimizarlos. Este proceso de fabricación es esencial para garantizar la seguridad y la eficacia de los medicamentos producidos.
La adopción de un enfoque de gestión del riesgo tiene varias ventajas. En primer lugar, permite a las empresas identificar y abordar proactivamente los riesgos antes de que se conviertan en problemas. Esto puede ayudar a prevenir problemas de calidad y seguridad, y a evitar costosas retiradas de productos por mala manipulación de alimentos.
En segundo lugar, la gestión del riesgo puede ayudar a las empresas a optimizar sus procesos de producción o procedimientos operativos. Al identificar los riesgos y tomar medidas para controlarlos, las empresas pueden mejorar la eficiencia y la eficacia de sus operaciones.
Finalmente, la gestión del riesgo proporciona a las empresas un mecanismo para defender sus prácticas ante las autoridades sanitarias. Al demostrar que han identificado y controlado los riesgos asociados con la producción, las empresas pueden mostrar que están cumpliendo con las BPF y garantizando la seguridad y la eficacia de sus productos con sistemas de calidad.
Por lo tanto, el enfoque en la gestión del riesgo en las BPF es una herramienta valiosa para las empresas farmacéuticas. Permite a las empresas identificar y controlar los riesgos, mejorar sus operaciones y demostrar su compromiso con la calidad y la seguridad del proceso productivo.
ICHQ9: Gestión del riesgo en la normativa ANMAT4159/2023
El ICHQ9, también conocido como la Guía de Gestión de Riesgos de Calidad, es una herramienta esencial en las Buenas Prácticas de Fabricación (BPF) y juega un papel crucial en la ANMAT 4159/2023. Este enfoque en la gestión del riesgo es un componente fundamental para garantizar la calidad y la seguridad en la producción de medicamentos, en condiciones de higiene.
La gestión del riesgo, según la norma ICHQ9, implica la identificación sistemática de los riesgos asociados con la producción de medicamentos, la evaluación de estos riesgos en términos de su probabilidad y gravedad, y la implementación de medidas para controlar y minimizar estos riesgos o retiro de productos. Este proceso de fabricación es esencial para garantizar la seguridad y la eficacia de los medicamentos producidos.
Además, la gestión del riesgo proporciona a las empresas las herramientas necesarias para definir y generar los procedimientos que deben cumplir. Esto significa que cada empresa tiene la responsabilidad de identificar los riesgos asociados con sus procesos de producción y de implementar las medidas necesarias para controlarlos.
Implicaciones de la normativa ANMAT 4159/2023
La nueva normativa ANMAT 4159/2023 tiene implicaciones significativas para varios organismos. Las Buenas Prácticas de Fabricación (BPF) son un componente esencial en la producción y control de medicamentos. La adopción de nuevos requerimientos internacionales y un enfoque en la gestión del riesgo representa un cambio significativo. Por lo que, estos organismos deben revisar y actualizar sus procedimientos para garantizar que cumplen con las nuevas directrices.
Además, la normativa también tiene implicaciones para los procesos biotecnológicos. La inclusión de estos procesos en la normativa refleja la creciente importancia de la biotecnología en la industria farmacéutica. Los organismos que se dedican a la biotecnología deben asegurarse de que sus procesos cumplen con las BPF y de que están en línea con los nuevos requerimientos internacionales.
La normativa también establece un plazo para la entrada en vigencia de las nuevas regulaciones. La cual entrará en vigencia a los 30 días hábiles de su publicación en el Boletín Oficial. Esto significa que los organismos tienen un plazo limitado para adaptarse a las nuevas regulaciones y asegurarse de que cumplen con los nuevos estándares.
La adaptación a la ANMAT 4159/2023 representa un desafío para estos organismos, pero también una oportunidad. Al adoptar las nuevas regulaciones, pueden mejorar la calidad y la seguridad de los medicamentos que producen, y demostrar su compromiso con las Buenas Prácticas de Fabricación. Además, al cumplir con las nuevas regulaciones, también pueden mantener la confianza del público y de las autoridades sanitarias en sus productos y prácticas. Evitando así el retiro de productos y obteniendo una correcta fabricación e higiene adecuada durante la fabricación de productos.
Tomar las precauciones necesarias, permitirá lograr un control de calidad del producto si se llevan a cabo las normas de calidad. Por lo que es importante tener en cuenta los aspectos del proceso, los controles de procesos y la capacitación del personal. Ya que con un personal involucrado, se puede aplicar una medida de control o medidas adecuadas para adaptarse a la norma ANMAT 4159/2023. Al mismo tiempo que se aplican en los laboratorios farmacéuticos las Buenas Prácticas de Fabricación para una buena gestión de calidad, con controles de calidad y una correcta fabricación a través de medidas correctivas en procesos productivos.