Contenidos en este artículo
El Decreto 79 se erige como un pilar fundamental en el ámbito regulatorio de productos farmacéuticos y terapias avanzadas en Chile. Este marco de normativa complementaria no sólo establece estándares rigurosos para la producción y distribución de medicamentos, sino que también garantiza la calidad y seguridad de los tratamientos disponibles para los pacientes. A lo largo de este blog, desentrañaremos las complejidades del Decreto 79, examinando cómo se entrelaza con otras normativas vigentes esenciales, como las Buenas Prácticas de Manufactura, y cómo estas regulaciones colectivas contribuyen a mantener un alto estándar en la atención médica. Además, abordaremos los desafíos particulares que implica la implementación de terapias avanzadas en la región, resaltando la importancia crítica del Decreto 79 en este entorno. A continuación, nos sumergimos en cada uno de estos temas clave, proporcionando una visión integral y detallada del impacto y la relevancia del Decreto 79 en el sector farmacéutico y de terapias avanzadas.
Desglose del Decreto 79: Pilares y Directrices
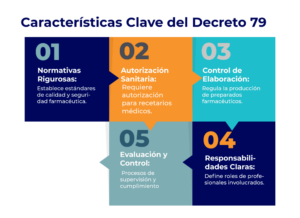
El Decreto 79, promulgado por el Ministerio de Salud de Chile, constituye un marco regulatorio crucial para la gestión de productos farmacéuticos, asegurando la calidad y seguridad de estos esenciales elementos en el ámbito de la salud. Este decreto abarca desde la elaboración y control de los medicamentos hasta su dispensación, estableciendo procedimientos claros y detallados para cada etapa del proceso.
Este segmento del artículo tiene como objetivo proporcionar un análisis exhaustivo del Decreto 79, explorando sus pilares fundamentales y las directrices que lo conforman. Nos adentraremos en los aspectos más significativos de este marco normativo, desglosando su estructura y destacando la importancia de cada uno de sus componentes en la regulación de los productos farmacéuticos.
El Decreto 79 no solo establece las bases para la autorización y control de los medicamentos, sino que también define las responsabilidades del profesional químico involucrado y los registros necesarios para garantizar la trazabilidad y seguridad de los productos. A través de este análisis, buscaremos entender cómo este decreto contribuye a crear un entorno seguro y regulado, asegurando que los productos farmacéuticos cumplan con los más altos estándares de calidad.
A continuación, veremos los detalles del Decreto 79, explorando su rol como marco regulatorio esencial en la industria farmacéutica y analizando los procesos de autorización y control que establece. Este desglose nos permitirá apreciar la complejidad y la importancia de este decreto en la garantía de la calidad y seguridad de los productos farmacéuticos en Chile.
El Decreto 79: Un Marco Regulatorio Esencial
El Decreto 79 del Ministerio de Salud de Chile representa un marco regulatorio fundamental para la gestión de productos farmacéuticos en el país. Este decreto establece la normativa vigente y procedimientos necesarios para la elaboración, control y dispensación de preparados farmacéuticos, asegurando así su calidad y seguridad. A través de sus disposiciones, el Decreto 79 busca garantizar que los productos farmacéuticos sean seguros y eficaces, protegiendo la salud de los consumidores.
También aborda diversos aspectos del proceso farmacéutico, desde la elaboración y control de calidad hasta la dispensación de los productos. Establece las responsabilidades del profesional farmacéutico involucrado, así como los registros necesarios para asegurar la trazabilidad y calidad de los medicamentos. Además, el Decreto 79 pone especial énfasis en las precauciones de almacenamiento y las etiquetas de los productos, para prevenir errores y garantizar la correcta administración de los medicamentos.
Este segmento es una visión detallada de los aspectos más relevantes del Decreto 79, destacando su rol crucial en la regulación de los productos farmacéuticos en Chile. Al comprender las directrices establecidas por este decreto, podemos apreciar cómo contribuye a establecer un estándar elevado en la atención médica y la seguridad de los pacientes.
Autorización y Control: Los Dos Pilares del Decreto 79
La autorización sanitaria y los procedimientos de control de calidad son dos pilares fundamentales del Decreto 79, trabajando conjuntamente para asegurar la calidad y seguridad de los productos farmacéuticos. “En Cercal, nuestra misión es ser el puente entre la innovación y la implementación”, comenta Claudia Velasco, CEO de Cercal Group, destacando la importancia de la autorización sanitaria como primer paso en el proceso de garantizar productos seguros y eficaces.
Este proceso de autorización sanitaria evalúa y aprueba la idoneidad de los productos y los establecimientos involucrados en su elaboración y distribución, asegurando que cumplan con los estándares establecidos y protegiendo la salud de los consumidores. “Trabajamos directamente con las agencias regulatorias para garantizar que los medicamentos cumplan con todos los estándares de seguridad y eficacia”, añade Velasco.
Por otro lado, los procedimientos de control de calidad establecidos en el Decreto 79 son esenciales para monitorear y asegurar la calidad de los productos a lo largo de todo su ciclo de vida. “La regulación es una de las áreas más desafiantes, pero proporcionamos asesoramiento experto en regulaciones tanto locales como internacionales”, explica Velasco, resaltando la importancia de los controles de calidad.
En conjunto, la autorización sanitaria y los procedimientos de control de calidad forman un sistema robusto de regulación, trabajando para mantener los más altos estándares de calidad y seguridad. “Estamos aquí para apoyar y asegurarnos de que las innovaciones lleguen a quienes más lo necesitan”, concluye Velasco, subrayando el compromiso de Cercal con la excelencia en el sector farmacéutico.
Buenas Prácticas de Manufactura en Productos Farmacéuticos de Investigación Clínica
La implementación de las Buenas Prácticas de Manufactura (BPM) en la producción y manejo de productos farmacéuticos es un aspecto crucial, especialmente en el contexto de la investigación clínica. Estas prácticas no solo aseguran la calidad y seguridad de los productos, sino que también juegan un papel vital en la protección de los participantes en ensayos clínicos. A través de la estandarización de procesos y la implementación de controles rigurosos, las BPM buscan minimizar los riesgos asociados con la producción y uso de productos farmacéuticos.
En esta sección, nos sumergiremos en el mundo de las Buenas Prácticas de Manufactura, explorando su importancia, las directrices que establecen, y cómo estas se aplican en la práctica. Además, analizaremos la conexión implícita entre las BPM y el Decreto 79, destacando cómo ambos trabajan conjuntamente para formar un marco regulatorio sólido y confiable.
Las BPM no son solo un conjunto de reglas a seguir; son una filosofía de trabajo que pone la calidad y la seguridad en el centro de todo el proceso de producción. Desde la selección de materias primas hasta los procedimientos de fabricación y control de calidad, cada paso está meticulosamente diseñado para asegurar que los productos finales cumplan con los más altos estándares de calidad.
Al adoptar estas prácticas, las empresas no solo cumplen con las regulaciones locales e internacionales, sino que también demuestran su compromiso con la seguridad y bienestar de los consumidores. En los siguientes apartados, profundizaremos en los aspectos específicos de las BPM, su aplicación en productos farmacéuticos de investigación clínica, y su relación intrínseca con el marco regulatorio chileno, proporcionando así una comprensión completa de su relevancia y aplicación en la industria farmacéutica.
Importancia de las Buenas Prácticas de Manufactura (BPM)
Las Buenas Prácticas de Manufactura (BPM) son cruciales para garantizar la calidad y seguridad de los productos farmacéuticos, especialmente en investigaciones clínicas. De acuerdo a Claudia Velasco, CEO de Cercal Group, la producción en terapias avanzadas, que involucra complejos procesos biológicos, requiere de un enfoque riguroso y estandarizado. Las BPM aseguran una fabricación consistente y controlada, minimizando riesgos de contaminación o errores, y demostrando el compromiso con la seguridad del paciente y la integridad del producto. “Un proyecto bien estructurado de laboratorio con URS enfocadas a cumplimiento Clínico y GMP es fundamental”, destaca Velasco, subrayando la importancia de adherirse a estas prácticas. Además, resalta el papel de la tecnología en la seguridad e integridad de los datos obtenidos de los usuarios de estos productos. En resumen, las BPM son un componente esencial en la cadena de producción farmacéutica, asegurando la eficacia y seguridad de los medicamentos desde su creación hasta su consumo.
El Instructivo de BPM: Directrices y Aplicaciones
El “Instructivo para Formato de Certificado de BPM para Productos Farmacéuticos en Investigación Clínica” establece directrices claras para la implementación de Buenas Prácticas de Manufactura. Detalla los procedimientos y requisitos necesarios para obtener la certificación de BPM, un paso crucial para la importación y uso de productos farmacéuticos en investigaciones clínicas en Chile. Al seguir estas directrices, las empresas aseguran que sus productos y receta médica cumplen con los estándares de calidad y seguridad establecidos, minimizando así los riesgos asociados con la producción y uso de medicamentos. Este instructivo actúa como una guía práctica para el profesional responsable, proporcionando a las empresas las herramientas necesarias para navegar por el complejo mundo de la regulación farmacéutica y asegurar la calidad de sus productos.
Conexión Implícita con el Decreto 79
Aunque el Decreto 79 no se menciona explícitamente, su influencia en las Buenas Prácticas de Manufactura es evidente. El instructivo de BPM y el Decreto 79 comparten el objetivo común de asegurar la calidad y seguridad de los productos farmacéuticos, trabajando juntos para crear un entorno regulado y seguro. Las BPM refuerzan los estándares establecidos por el Decreto 79, proporcionando un marco práctico para su implementación. Esta conexión implícita entre ambos documentos demuestra la cohesión en la regulación farmacéutica chilena, asegurando que los productos farmacéuticos cumplan con los más altos estándares de calidad y seguridad en condiciones contempladas.
Casos Excepcionales y Alternativas
El instructivo de BPM también aborda situaciones excepcionales, ofreciendo soluciones y alternativas para casos en los que no se puede obtener un certificado de BPM del país de origen. Estas directrices aseguran que, incluso en circunstancias atípicas, los estándares de calidad y seguridad se mantengan intactos. Al proporcionar opciones y soluciones claras, el instructivo garantiza que las empresas puedan navegar por estos escenarios excepcionales sin comprometer la integridad de sus productos o la seguridad de los consumidores. Estas alternativas son cruciales para mantener la confianza en los productos farmacéuticos y asegurar la protección continua de la salud pública.
Desafíos de la Regulación de Terapias Avanzadas
La regulación de terapias avanzadas representa un territorio complejo y en constante evolución dentro del ámbito farmacéutico. Estas terapias, que incluyen la terapia génica, la terapia celular y la ingeniería de tejidos, ofrecen un potencial sin precedentes para tratar y, en algunos casos, curar enfermedades que anteriormente se consideraban intratables. Sin embargo, su novedad y complejidad presentan desafíos únicos en términos de regulación y supervisión.
Uno de los principales desafíos radica en la naturaleza misma de las terapias avanzadas. A diferencia de los medicamentos tradicionales, estas terapias a menudo se personalizan para el paciente individual y pueden involucrar la manipulación de células vivas. Esto plantea preguntas sobre cómo se deben evaluar y monitorear su seguridad y eficacia, y cómo se pueden estandarizar los procesos de producción para garantizar la consistencia y calidad del producto.
Además, la velocidad a la que avanzan estas terapias puede superar la capacidad de los organismos reguladores para evaluarlas y aprobarlas de manera oportuna. Esto puede resultar en retrasos en llevar estas terapias innovadoras a los pacientes que las necesitan. Al mismo tiempo, existe la necesidad de equilibrar la urgencia de poner a disposición estas terapias con la necesidad de realizar evaluaciones exhaustivas para garantizar su seguridad.
Otro desafío es la falta de un marco regulatorio armonizado a nivel internacional. Dado que muchas terapias avanzadas se desarrollan y producen en un país. Pero se utilizan en otro, la falta de coherencia en la regulación entre países puede complicar su aprobación y uso.
Estas terapias a menudo tienen costos de producción y desarrollo significativamente más altos que los medicamentos tradicionales, lo que plantea preguntas sobre su accesibilidad y asequibilidad para los pacientes.
Navegar por estos desafíos en el sector diferenciado, requerirá un enfoque colaborativo entre los desarrolladores de terapias, los organismos reguladores y otros actores clave. Así como la adaptación continua de los marcos regulatorios para mantenerse al día con los avances en la ciencia y la tecnología en normativa vigente.
Desafíos y Recomendaciones en Terapia Celular: Una Perspectiva Regional
La terapia celular está emergiendo como una prometedora vía de tratamiento para diversas enfermedades, pero su regulación presenta desafíos únicos, especialmente en la región latinoamericana. A continuación, se exploran algunos de estos desafíos y se ofrecen recomendaciones para abordarlos:
- Establecimiento de Marcos Regulatorios: En muchos países de la región, aún se está trabajando en el desarrollo de marcos regulatorios específicos para terapias celulares. Es crucial acelerar este proceso para garantizar la seguridad y eficacia de estos tratamientos.
- Armonización de Regulaciones: Existe una gran variabilidad en las regulaciones entre diferentes países. Trabajar hacia la armonización de los marcos regulatorios facilitaría el intercambio de información y la colaboración regional.
- Capacitación y Educación: Es fundamental invertir en la capacitación y decisión del profesional habilitado de la salud y los reguladores. Para que estén mejor equipados para evaluar y supervisar las terapias celulares.
- Fomento de la Investigación y Desarrollo: Se deben crear incentivos para fomentar la investigación y el desarrollo de terapias celulares en la región, asegurando que los pacientes tengan acceso a tratamientos innovadores.
- Acceso y Asequibilidad: Trabajar para hacer que las terapias celulares sean accesibles y asequibles para todos los pacientes, independientemente de su situación económica.
- Vigilancia Post-Mercado: Establecer sistemas robustos de vigilancia post-mercado para monitorear la seguridad y eficacia de las terapias celulares una vez que estén en el mercado.
Estos desafíos y recomendaciones destacan la necesidad de un enfoque coordinado y colaborativo para regular las terapias celulares en la región. Asegurando que los pacientes tengan acceso a tratamientos seguros y efectivos.
Terapias Génicas, Celulares y Tisulares: Un Terreno en Evolución
Las terapias génicas, celulares y tisulares representan un avance significativo en la medicina moderna, ofreciendo nuevas posibilidades para tratar enfermedades previamente intratables. Estas terapias avanzadas implican la manipulación de material genético, células vivas o tejidos, y presentan desafíos únicos en términos de regulación y supervisión.
La naturaleza novedosa y la complejidad de estas terapias requieren un marco regulatorio que asegure su seguridad y eficacia. Es crucial que los organismos reguladores adopten un enfoque que combine rigurosidad y flexibilidad, adaptándose a las características particulares de estas terapias avanzadas.
En este contexto, el Decreto 79, aunque no aborda directamente las terapias avanzadas. Establece principios generales de calidad y seguridad que son fundamentales para cualquier producto farmacéutico. Estos principios pueden servir como base para la regulación de terapias génicas, celulares y tisulares. Asegurando que cumplan con estándares estrictos de seguridad y calidad del preparado.
La regulación de estas terapias también implica desafíos relacionados con la estandarización de los procesos de producción y la evaluación de su seguridad a largo plazo. Dada la naturaleza personalizada de muchas de estas terapias, es esencial desarrollar métodos de evaluación que puedan adaptarse a sus características únicas.
Además, la rápida evolución de la ciencia y la tecnología en este campo plantea la necesidad de un marco regulatorio que pueda mantenerse al día con los avances científicos. Esto requiere un compromiso constante por parte de los organismos reguladores para actualizar y adaptar las regulaciones. Asegurando que las terapias avanzadas disponibles para los pacientes sean seguras y efectivas.
La regulación de las terapias génicas, celulares y tisulares es un terreno en evolución que presenta desafíos significativos. Pero también ofrece oportunidades para mejorar la atención médica y el tratamiento de enfermedades. La adopción de un marco regulatorio basado en principios de calidad y seguridad, como los establecidos en el Decreto 79. Es esencial para navegar por este terreno complejo y asegurar los beneficios de estas terapias avanzadas para los pacientes.
Conclusión
La regulación en el ámbito farmacéutico y de terapias avanzadas es crucial para asegurar la seguridad y eficacia de los tratamientos disponibles. “Apoyamos a las empresas en áreas como la investigación, regulación, logística y comercialización”, señala Claudia Velasco, CEO de Cercal Group, resaltando la importancia del Decreto 79 en el establecimiento de estándares rigurosos para la elaboración y dispensación de productos farmacéuticos.
Hemos explorado también las Buenas Prácticas de Manufactura, destacando su rol esencial en la garantía de calidad de los productos farmacéuticos en investigación clínica. “Es fundamental tener un proyecto bien estructurado de laboratorio con URS enfocadas a cumplimiento Clínico y GMP”, enfatiza Velasco, subrayando la necesidad de adherirse a estas prácticas.
Además, hemos abordado los desafíos y oportunidades asociados con las terapias avanzadas, un campo en constante evolución que requiere una atención regulatoria especializada. “Aunque el camino hacia la innovación puede ser desafiante, no están solos en este viaje”, asegura Velasco, destacando el apoyo de Cercal en este proceso.
Es evidente que un marco regulatorio sólido y adaptativo es esencial en el sector farmacéutico y de terapias avanzadas, no solo para asegurar la seguridad y eficacia de los tratamientos, sino también para fomentar la innovación. “Estamos emocionados por el futuro de la medicina y nuestro papel en él”, concluye Velasco, resaltando el compromiso de Cercal con la mejora continua y la adaptación a los cambios en este sector dinámico.