Contenidos en este artículo
El Informe 55 OMS marca un hito crucial para el sector farmacéutico global. Este documento detalla avances significativos en la regulación y calidad de los productos farmacéuticos.
Su elaboración contó con la participación activa del sector privado, asegurando una perspectiva amplia y aplicable. Aborda desafíos como la exposición a gases en la producción farmacéutica, un tema de creciente preocupación.
Además, el informe pone énfasis en la seguridad laboral, destacando los riesgos de la exposición a jornadas extensas en entornos de alta demanda. La exposición prolongada a agentes químicos nocivos recibe una atención especial, proponiendo directrices para minimizar riesgos.
El Informe 55 OMS se erige como una guía esencial para mejorar continuamente la seguridad y eficacia en el sector, incluyendo medidas contra la exposición a riesgos laborales.

La evolución de las prácticas regulatorias a través del Informe 55 OMS
El Informe 55 OMS ha marcado un antes y un después en la regulación farmacéutica. Este documento, fruto de un exhaustivo análisis, propone mejoras significativas en las prácticas regulatorias.
Su influencia se extiende a cómo las agencias reguladoras y el sector privado abordan la seguridad y eficacia de los medicamentos. Una de las recomendaciones clave se centra en la minimización de la exposición a niveles peligrosos de sustancias en la fabricación de fármacos.
El informe también aborda la exposición a sonidos dentro de las plantas de producción, sugiriendo medidas para proteger la salud auditiva de los trabajadores. Esta atención a la seguridad laboral subraya la importancia de un ambiente de trabajo seguro en la industria farmacéutica.
Además, el Informe 55 OMS pone de relieve cómo la exposición al amianto aumentó la conciencia sobre los riesgos laborales, llevando a una revisión de las prácticas de manejo de materiales peligrosos.
- Minimización de riesgos: El informe enfatiza la reducción de la exposición a sustancias peligrosas.
- Protección auditiva: Se recomiendan estrategias para mitigar los efectos nocivos del ruido en el entorno laboral.
- Manejo seguro de materiales: Se destacan las mejores prácticas para el manejo del amianto y otros materiales riesgosos.
Estas directrices no sólo buscan proteger a los trabajadores, sino también asegurar que los productos farmacéuticos sean seguros y efectivos para los consumidores.
La exposición laboral a riesgos se aborda con un enfoque preventivo, demostrando el compromiso de la OMS con la salud pública y la seguridad en el sector farmacéutico.
Cómo el Informe 55 OMS ha mejorado la garantía de calidad durante la COVID-19
El Informe 55 OMS ha sido fundamental en la mejora de la garantía de calidad de los productos farmacéuticos durante la pandemia de COVID-19. Este documento ha establecido un marco de referencia que ha permitido a entidades del sector farmacéutico y reguladores adaptarse rápidamente a los desafíos emergentes.
Asegurando que los medicamentos y vacunas desarrollados cumplan con los más altos estándares de calidad y seguridad.
Marco Regulatorio Reforzado
El informe ha reforzado el marco regulatorio, integrando el riesgo con base científica en la evaluación de productos. Esta aproximación ha permitido una respuesta más ágil y fundamentada ante la urgencia de tratamientos y vacunas para la COVID-19, sin comprometer la seguridad.
La adopción de normas internacionales en la evaluación de riesgos ha sido clave para mantener la integridad y eficacia de los productos farmacéuticos en circulación.
Estándares de Calidad Elevados
Al establecer una norma mundial para la garantía de calidad, el Informe 55 ha elevado los estándares en la producción de medicamentos. Esta normativa ha sido crucial para minimizar el riesgo de daño a los pacientes, asegurando que los productos liberados al mercado durante la pandemia sean tanto efectivos como seguros.
La implementación de estas directrices ha reforzado la confianza pública en las intervenciones médicas disponibles.
Colaboración Internacional
La colaboración entre entidades reguladoras y la industria farmacéutica ha sido vital para enfrentar la pandemia. El informe ha fomentado una cooperación sin precedentes, alineando las prácticas regulatorias a nivel global.
Esta sinergia ha acelerado el desarrollo y distribución de soluciones terapéuticas, demostrando el valor de una norma internacional compartida y la importancia de un enfoque unificado ante crisis sanitarias globales.
El Informe 55 OMS ha demostrado ser un recurso invaluable en estos tiempos críticos, guiando a las entidades del sector hacia una garantía de calidad robusta y coherente.
Actualizaciones de la Farmacopea Internacional y su impacto según el Informe 55 OMS
El Informe 55 OMS ha jugado un papel crucial en la actualización de la Farmacopea Internacional, impactando significativamente la calidad y seguridad de los medicamentos a nivel mundial.
Estas actualizaciones han sido esenciales para adaptarse a los avances científicos y tecnológicos en la fabricación de medicamentos, asegurando que los estándares reflejen las mejores prácticas actuales en la industria farmacéutica.
Una de las contribuciones más importantes ha sido la incorporación de un modelo de riesgo en la gestión de la calidad. Este enfoque permite a los fabricantes identificar, evaluar y controlar los riesgos a lo largo de todo el proceso de producción, minimizando así el riesgo de pérdida de calidad en los productos farmacéuticos.
La gestión del riesgo, centrada en la seguridad del paciente y la eficacia del medicamento, se ha convertido en un pilar fundamental de la garantía de calidad.
Además, las actualizaciones han enfatizado la importancia de la salud física de los pacientes, asegurando que los medicamentos no solo sean efectivos sino también seguros para el consumo a largo plazo.
Esto incluye la evaluación rigurosa de excipientes y principios activos, garantizando que cumplan con los más altos estándares de pureza y calidad.
- Incorporación de tecnologías avanzadas: Las nuevas tecnologías de fabricación y análisis han sido integradas en la Farmacopea, permitiendo una producción más eficiente y segura de medicamentos.
- Enfoque en la estabilidad del producto: Se han actualizado las directrices sobre la estabilidad de los medicamentos, crucial para mantener su eficacia y seguridad hasta el momento de su uso.
Estas actualizaciones reflejan el compromiso continuo de la OMS con la mejora de la calidad y seguridad de los medicamentos a nivel global, asegurando que los pacientes reciban tratamientos confiables y efectivos.
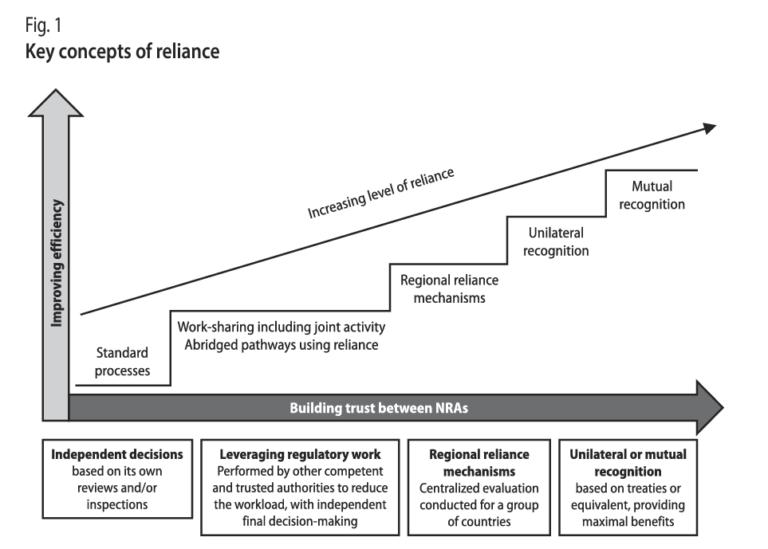
Reforzando la confianza en los sistemas regulatorios con el Informe 55 OMS
El Informe 55 OMS ha sido instrumental en reforzar la confianza en los sistemas regulatorios a nivel mundial. A través de sus recomendaciones, ha promovido la transparencia y la cooperación internacional como pilares fundamentales para la regulación de productos farmacéuticos.
Este enfoque ha permitido a las autoridades regulatorias y a las entidades del sector farmacéutico trabajar de manera más eficaz en el desarrollo, evaluación y aprobación de medicamentos seguros y efectivos.
Una estrategia clave ha sido la promoción de la transparencia en los procesos regulatorios. Al hacer públicos los criterios de evaluación y aprobación de medicamentos, el informe fomenta una mayor comprensión y confianza en las decisiones regulatorias.
Esto no solo beneficia a los profesionales de la salud y a los pacientes, sino que también facilita la colaboración entre las agencias regulatorias a nivel global.
La cooperación internacional, otro pilar destacado en el informe, ha sido esencial para armonizar los estándares regulatorios. Al compartir mejores prácticas y datos científicos, las autoridades regulatorias pueden acelerar la aprobación de medicamentos cruciales sin comprometer su seguridad.
Esta colaboración se ha visto especialmente reforzada en situaciones de emergencia sanitaria, como la pandemia de COVID-19, donde la rapidez y la eficacia son cruciales.
- Intercambio de información: El informe alienta el intercambio de información sobre inspecciones, evaluaciones y aprobaciones, lo que reduce la duplicación de esfuerzos y acelera el acceso a medicamentos seguros.
- Armonización de estándares: Trabajar hacia la armonización de estándares regulatorios facilita el comercio internacional de medicamentos y mejora el acceso a tratamientos innovadores.
Estas iniciativas, respaldadas por el Informe 55 OMS, han contribuido significativamente a fortalecer la confianza en los sistemas regulatorios.
Asegurando que los medicamentos que llegan a los pacientes son tanto seguros como efectivos.
La importancia de la innovación y colaboración internacional resaltada por el Informe 55 OMS
El Informe 55 OMS subraya la importancia crítica de la innovación y la colaboración internacional en el sector farmacéutico.
Este documento destaca cómo la cooperación entre países y entidades puede acelerar el desarrollo de soluciones médicas innovadoras, especialmente en tiempos de crisis global como la pandemia de COVID-19.
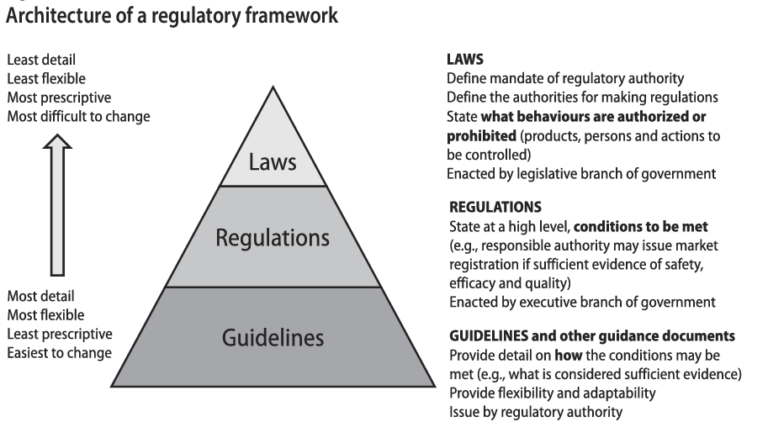
Fomento de la Innovación
El informe reconoce que la innovación es esencial para abordar los desafíos de salud pública emergentes. Promueve la investigación y el desarrollo (I+D) en áreas donde las necesidades médicas no están satisfechas y respalda el uso de tecnologías avanzadas para mejorar la eficacia y seguridad de los medicamentos.
La OMS alienta a las entidades del sector a adoptar enfoques innovadores en la fabricación de productos farmacéuticos, lo que puede resultar en tratamientos más efectivos y accesibles.
Colaboración Internacional
La colaboración internacional es otro pilar destacado en el informe. La OMS insta a las autoridades regulatorias, organizaciones de investigación y empresas farmacéuticas a trabajar conjuntamente en el desarrollo de normas y directrices que faciliten el acceso global a medicamentos seguros y efectivos.
Este enfoque colaborativo es vital para armonizar los estándares regulatorios y compartir las mejores prácticas, lo que permite una respuesta más rápida y coordinada a las emergencias sanitarias.
- Proyectos Conjuntos: El informe destaca proyectos conjuntos como el Proyecto de Bioexención de la OMS, que evalúa cómo ciertos medicamentos pueden ser aprobados basándose en estudios de laboratorio en lugar de ensayos clínicos, acelerando su disponibilidad.
- Cooperaciones Específicas: Se mencionan cooperaciones específicas con organizaciones como la Unión Europea (UE), la Agencia Europea de Medicamentos (EMA) y el Programa de Cooperación para la Inspección Farmacéutica (PIC/S), enfocadas en mejorar la calidad y seguridad de los medicamentos a nivel mundial.
La promoción de la innovación y la colaboración internacional por parte del Informe 55 OMS es fundamental para avanzar en la ciencia farmacéutica y mejorar la salud global.
Estas iniciativas no sólo impulsan el desarrollo de nuevos medicamentos, sino que también aseguran que los avances científicos sean accesibles en todas las regiones del mundo.
Cercal Group y su compromiso con las directrices del Informe 55 OMS

En Cercal Group, nuestro compromiso con la excelencia y la innovación en el sector farmacéutico. Nos impulsa a alinear nuestros servicios con las directrices establecidas en el Informe 55 OMS.
Entendemos la importancia de adherirnos a las normativas internacionales para garantizar la seguridad y eficacia de los productos farmacéuticos. Y es por eso que integramos las recomendaciones de este informe en todas nuestras operaciones.
Nuestro equipo de expertos, altamente calificado y con amplia experiencia en el sector farmacéutico. Trabaja incansablemente para implementar prácticas que reflejen las últimas actualizaciones en regulación y calidad.
Nos enfocamos en la innovación responsable, asegurando que todos nuestros proyectos y desarrollos cumplan con los estándares más altos de calidad y seguridad.
La colaboración internacional es otro pilar fundamental de nuestra estrategia. En Cercal Group, establecemos alianzas estratégicas con entidades reguladoras, organizaciones de investigación y otras compañías farmacéuticas a nivel global.
Estas colaboraciones nos permiten compartir conocimientos, experiencias y recursos. Lo que resulta en una mejora continua de nuestros servicios y en la aceleración del acceso a medicamentos seguros y efectivos para pacientes en todo el mundo.
Nos comprometemos a promover una cultura de transparencia y comunicación abierta, tanto dentro de nuestra organización como con nuestros socios y clientes. Este enfoque nos permite no solo cumplir con las regulaciones actuales, sino también anticiparnos a futuras actualizaciones y tendencias en el sector farmacéutico.
En Cercal Group, estamos dedicados a liderar por el ejemplo. Demostrando cómo el compromiso con las directrices del Informe 55 OMS puede traducirse en servicios de alta calidad que benefician a toda la industria farmacéutica. Y, lo más importante, a los pacientes a nivel mundial.
Conclusión
El Informe 55 OMS ha establecido un marco sin precedentes para la regulación y garantía de calidad en la industria farmacéutica. Este documento no solo ha servido como una brújula para las prácticas regulatorias y de calidad.
Sino que también ha fomentado una cooperación internacional más estrecha entre las autoridades reguladoras, la industria farmacéutica y las organizaciones de investigación. Al hacerlo, ha contribuido significativamente a la seguridad y eficacia de los medicamentos disponibles en el mercado global.
La importancia de este informe radica en su capacidad para adaptarse y responder a los desafíos emergentes, como lo demostró durante la pandemia de COVID-19.
Al proporcionar directrices claras y basadas en evidencia. El Informe 55 OMS ha permitido una movilización rápida de recursos y conocimientos. Para desarrollar, evaluar y distribuir tratamientos y vacunas de manera eficiente y segura.
Además, el enfoque en la innovación y la colaboración internacional destacado en el informe. Subraya la necesidad de un esfuerzo conjunto para abordar las crisis de salud pública.
La capacidad de compartir información, estándares y recursos entre países y organizaciones. Es fundamental para el avance de la medicina y la protección de la salud global.
En conclusión, el Informe 55 OMS ha sido y sigue siendo un pilar fundamental para el avance y la integridad de la industria farmacéutica.
Su influencia en la regulación, calidad y cooperación internacional asegura que el sector farmacéutico pueda enfrentar los retos actuales y futuros con confianza y eficacia.


