Contenidos en este artículo
Las Buenas Prácticas Clínicas (BPC) constituyen un pilar fundamental en la realización ética y científica de la investigación clínica, estableciendo estándares internacionales para la protección de los participantes y la validez de los datos.
Desarrolladas por el Consejo Internacional para la Armonización, estas directrices son esenciales para mantener la integridad y la transparencia en los ensayos clínicos.
A lo largo de este artículo, explicaremos en detalle los principios, la documentación necesaria y las estrategias de implementación de las BPC. Nuestro objetivo es resaltar la relevancia crítica de adherirse a las Buenas Prácticas Clínicas en la investigación médica contemporánea.
Orígenes y Desarrollo de las Buenas Prácticas Clínicas
Las Buenas Prácticas Clínicas (BPC) tienen sus raíces en una serie de directrices y regulaciones desarrolladas a lo largo del siglo XX. Con el objetivo de garantizar la seguridad y el bienestar de los participantes en ensayos clínicos, así como la integridad de los datos recopilados.
Antes de la existencia de estas normativas, no había garantías consistentes para la protección de los sujetos de investigación, lo que llevó a varios incidentes éticos notorios.
La necesidad de estandarización y regulación se hizo evidente, y en respuesta, se crearon diversas normativas y directrices a nivel nacional e internacional.
Uno de los primeros y más significativos fue la Declaración de Helsinki en 1964, que estableció principios éticos para la investigación médica involucrando sujetos de ensayo humanos.
Con el tiempo, la industria y los organismos reguladores reconocieron la necesidad de un conjunto de normas armonizadas a nivel internacional. Esto llevó a la creación de las Buenas Prácticas Clínicas por parte del Consejo Internacional para la Armonización de Requisitos Técnicos para Productos Farmacéuticos para Uso Humano (ICH) en 1996.
Estas directrices proporcionaron un marco global para la conducción de ensayos clínicos, asegurando la consistencia y la alta calidad en la investigación clínica a nivel mundial.
Desde su implementación, las BPC han sido adoptadas y seguidas por la industria farmacéutica, organismos reguladores y centros de investigación en todo el mundo, convirtiéndose en el estándar de oro para la realización de ensayos clínicos.
Su desarrollo y adopción han jugado un papel crucial en la mejora de la ética, la seguridad y la eficacia en la investigación clínica, asegurando que los derechos y el bienestar de los participantes sean siempre la prioridad.
Principios Fundamentales de las Buenas Prácticas Clínicas
Las Buenas Prácticas Clínicas (BPC) son un conjunto de estándares éticos y científicos establecidos para guiar la realización del ensayo clínico. Estos principios son esenciales para asegurar la seguridad de los participantes, la integridad de los datos recopilados y la validez de los resultados obtenidos.
A través de este artículo, exploramos los pilares fundamentales de las BPC, desglosando cada uno de ellos para entender su importancia y aplicación en la investigación clínica.
Al adherirse a estos principios, los investigadores y las instituciones pueden garantizar la conducción ética y científicamente rigurosa de los ensayos clínicos, contribuyendo así al avance seguro y efectivo de la medicina.
Protección de los Participantes
Los principios fundamentales de las Buenas Prácticas Clínicas (BPC) priorizan la seguridad y el bienestar de los participantes en ensayos clínicos. Se asegura que los riesgos sean mínimos y justificados, y que los participantes estén plenamente informados antes de dar su consentimiento.
Consentimiento Informado
Las BPC exigen la obtención del consentimiento informado de todos los participantes. Este proceso debe ser libre de coerción, y la información proporcionada debe ser clara y comprensible. Es un derecho del participante y una responsabilidad del investigador.
Integridad de los Datos
La veracidad y exactitud de los datos recopilados en ensayos clínicos son esenciales. Las BPC establecen normas para asegurar que los datos sean fiables y que se realice un seguimiento adecuado para cualquier corrección o modificación.
Diseño Científico Riguroso
Un ensayo clínico debe ser científicamente sólido y éticamente justificado. Las BPC guían la planificación, conducción y reporte de los ensayos para asegurar su validez y relevancia científica.
Calificación del Personal
Todos los involucrados en un ensayo clínico deben estar adecuadamente calificados y entrenados. Las BPC enfatizan la importancia de la competencia y la preparación del personal para garantizar la calidad y seguridad del ensayo.
Confidencialidad y Privacidad
La protección de la información personal de los participantes es primordial. Las BPC establecen directrices para asegurar que los datos sean manejados de manera confidencial y segura.
Cumplimiento Ético y Legal
Las BPC requieren que todos los ensayos clínicos cumplan con las leyes y regulaciones aplicables. Además, deben ser revisados y aprobados por un comité ético independiente antes de su inicio.
Documentación en Buenas Prácticas Clínicas: Un Pilar Esencial
Cada uno de estos documentos juega un papel vital en la realización de un ensayo clínico conforme a las Buenas Prácticas Clínicas, asegurando la transparencia, la integridad y la calidad en la investigación clínica.
- Plan de Estudio: Documento que detalla el diseño, objetivos y metodología del ensayo clínico. Es crucial para entender la estructura y propósito del estudio clínico.
- Manual del Investigador: Proporciona instrucciones detalladas sobre cómo llevar a cabo el ensayo, asegurando la estandarización y calidad en todos los sitios de investigación.
- Formularios de Consentimiento Informado: Documentos esenciales que explican los riesgos, beneficios y derechos del participante. La FDA proporciona guías para asegurar que el proceso de consentimiento informado se realice correctamente.
- Registros de Pacientes: Incluyen toda la información médica relevante del participante, asegurando que los investigadores clínicos tengan acceso a datos precisos y actualizados.
- Documentación de Monitoreo: Registra las visitas de los monitores clínicos, asegurando que el ensayo se realice conforme a las BPC y a los protocolos establecidos.
- Informes de Seguridad: Documentan cualquier evento adverso o efecto secundario que experimenten los participantes, proporcionando datos cruciales para evaluar la seguridad del tratamiento.
- Registros de Calidad: Incluyen auditorías y revisiones de calidad, asegurando que todos los aspectos del ensayo clínico cumplan con los estándares de las BPC.
- Informes Finales: Resumen los resultados y conclusiones del ensayo, proporcionando una visión completa del estudio clínico y sus hallazgos.
“La FDA tiene un fuerte interés en asegurar que los sujetos de investigación estén protegidos y que los datos obtenidos en los estudios sean confiables. Para lograr estos objetivos, la FDA espera que los estudios clínicos se conduzcan de acuerdo con las Buenas Prácticas Clínicas (BPC).” – Administración de Alimentos y Medicamentos de EE. UU. (FDA)
El Rol de los Comités de Ética en las Buenas Prácticas Clínicas
Los Comités de Ética dirigida desempeñan un papel crucial en la supervisión de los ensayos clínicos, asegurando que se adhieran a las Buenas Prácticas Clínicas y protegiendo los derechos del paciente y el bienestar de los participantes.
Estos comités son responsables de revisar y aprobar los protocolos de investigación, evaluando si los riesgos para los participantes son mínimos y justificables. Además, supervisan el proceso de consentimiento informado para asegurarse de que se proporcione toda la información necesaria de manera clara y comprensible.
Estos comités también juegan un papel vital en la monitorización continua de los ensayos clínicos. Evalúan los informes de eventos adversos y aseguran que se tomen las medidas adecuadas para proteger a los participantes. Su objetivo es mantener un equilibrio entre la obtención de conocimientos científicos y la protección de los derechos humanos.
“En Chile, estos estamentos se han denominado Comités Ético Científicos, los que deben acreditarse ante la autoridad sanitaria competente y cumplir con las regulaciones pertinentes.” – Instituto de Salud Pública de Chile
La composición de los Comités de Ética es diversa, incluyendo profesionales médicos, expertos en ética, y representantes de la comunidad. Esta diversidad asegura una evaluación completa y justa de los ensayos clínicos desde múltiples perspectivas.
Además, estos comités tienen la autoridad para detener un ensayo clínico si consideran que no se están siguiendo las Buenas Prácticas Clínicas o si la seguridad de los participantes está en riesgo.
Los Comités de Ética son esenciales para mantener la integridad y la ética en la investigación clínica. Su supervisión y guía aseguran que los ensayos clínicos se realicen de acuerdo con las más altas normas éticas y científicas, protegiendo así a los participantes y contribuyendo al avance de la medicina.
Gestión de Datos y Seguridad del Paciente en Buenas Prácticas Clínicas
La gestión de datos y la seguridad del paciente son componentes cruciales en las Buenas Prácticas Clínicas (BPC), asegurando la validez y confiabilidad de los resultados de los ensayos clínicos, así como la protección y el bienestar de los participantes.
Estos aspectos son fundamentales para mantener la integridad de la investigación y garantizar la confianza en los hallazgos científicos.
Recopilación de Datos Precisos
La exactitud en la recopilación de datos es esencial. Se deben utilizar herramientas y software especializados para asegurar que los datos recopilados sean veraces y fiables. Además, es crucial realizar el control de calidad y validación de los datos para identificar y corregir cualquier error o inconsistencia.
El Consejo Internacional para la Armonización de Requisitos Técnicos para Productos Farmacéuticos para Uso Humano (ICH) proporciona directrices claras sobre cómo se deben manejar estos procesos.
Almacenamiento Seguro de Datos
Los datos recopilados deben ser almacenados de manera segura para prevenir accesos no autorizados o pérdidas de información. Es imperativo implementar medidas de seguridad robustas y crear copias de seguridad regulares. Además, se debe garantizar la confidencialidad de la información personal de los participantes, siguiendo las pautas establecidas por el ICH.
Manejo de Datos e Información Sensible
La privacidad de los participantes es primordial. Es necesario asegurar que los datos personales sean manejados de forma confidencial y que se obtenga el consentimiento informado para el uso de su información. La transparencia con los participantes sobre cómo se utilizarán sus datos es un aspecto clave, y el ICH enfatiza la importancia de este proceso.
Seguridad del Paciente
Se debe mantener una vigilancia constante sobre la salud pública y el bienestar de los participantes. Esto incluye el monitoreo regular y el reporte inmediato de cualquier evento adverso. Además, se deben implementar medidas correctivas cuando sea necesario para mitigar riesgos y proteger a los participantes, siguiendo las recomendaciones del ICH.
Cumplimiento Normativo
Es esencial adherirse a las directrices de las BPC en todos los aspectos de la gestión de datos y la seguridad del paciente. Esto incluye la realización de auditorías periódicas para asegurar el cumplimiento de las normativas y la implementación de mejoras continuas basadas en los hallazgos de estas revisiones.
El ICH juega un papel crucial en establecer estas normativas y asegurar su cumplimiento a nivel mundial.
La gestión de datos obtenidos y la seguridad del paciente son aspectos fundamentales en las Buenas Prácticas Clínicas, desempeñando un papel vital en la aseguración de la integridad de la investigación clínica y la protección de los participantes, con el ICH proporcionando el marco necesario para su implementación efectiva.
Implementación y Cumplimiento de las Buenas Prácticas Clínicas
La implementación y el cumplimiento de las Buenas Prácticas Clínicas (BPC) son esenciales para asegurar la integridad y la calidad científica en la investigación clínica.
Estos principios establecidos a nivel internacional por el Consejo Internacional para la Armonización de Requisitos Técnicos para Productos Farmacéuticos para Uso Humano (ICH). Deben ser seguidos rigurosamente por todos los involucrados en ensayos clínicos.
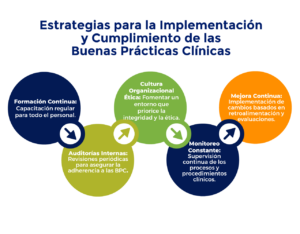
A continuación, se detallan las estrategias y acciones clave para asegurar la implementación y el cumplimiento efectivo de las BPC:
- Formación y Capacitación Continua: Proporcionar formación previa regular y actualizada a todo el personal involucrado en ensayos clínicos sobre los principios y requisitos de las BPC.
- Desarrollo de Protocolos Claros y Detallados: Elaborar protocolos de investigación que cumplan con los estándares de las BPC y que sean revisados y aprobados por un Comité de Ética.
- Monitoreo y Auditorías Regulares: Realizar monitoreo constante y auditorías periódicas para asegurar que los ensayos clínicos se estén llevando a cabo conforme a las BPC.
- Gestión Efectiva de los Datos: Implementar sistemas de gestión de datos obtenidos que aseguren la precisión, integridad y confidencialidad de la información recopilada.
- Reporte Transparente y Completo: Asegurar que los resultados y hallazgos de los ensayos clínicos sean reportados de manera transparente y completa, siguiendo las directrices de las BPC.
Estas estrategias son fundamentales para garantizar que los ensayos clínicos se realicen de manera ética, segura y eficaz. Asegurando la protección de los participantes y la validez de los resultados obtenidos.
Desafíos y Futuro de las Buenas Prácticas Clínicas
Las BPC han transformado la investigación clínica, estableciendo estándares éticos y científicos rigurosos. A pesar de su éxito, existen desafíos constantes y emergentes que requieren atención y adaptación. El futuro de las BPC dependerá de cómo se aborden estos desafíos, buscando siempre mejorar y fortalecer los procesos de investigación clínica.
| Desafío | Descripción | Impacto Potencial en el Futuro de las BPC |
| Adaptación Tecnológica | Integrar nuevas tecnologías y plataformas digitales en los procesos de investigación. | Mayor eficiencia y precisión en la recopilación y análisis de datos. |
| Globalización de la Investigación | Armonizar las BPC a nivel internacional para asegurar consistencia en los estándares. | Establecimiento de normativas globales más uniformes y efectivas. |
| Protección de Datos | Asegurar la confidencialidad y seguridad de los datos en un entorno digital. | Fortalecimiento de las medidas de seguridad y privacidad. |
| Participación del Paciente | Fomentar una mayor inclusión y participación activa de los pacientes en los ensayos. | Investigación más centrada en el paciente y resultados más relevantes. |
| Formación y Capacitación | Proporcionar educación continua y actualizada a todos los involucrados en la investigación. | Mejora en la calidad de datos y la adherencia a las BPC. |
Estos desafíos representan oportunidades para mejorar y fortalecer las BPC, asegurando que continúen siendo un pilar fundamental en la investigación clínica y contribuyan al avance de la medicina de manera ética y eficaz.
Conclusión
Las Buenas Prácticas Clínicas (BPC) son el corazón de nuestra labor en Cercal Group, proporcionando un marco ético y científico esencial para la investigación clínica.
A lo largo de este análisis, hemos profundizado en los principios, la documentación rigurosa y el papel vital de los Comités de Ética, todos cruciales para garantizar la seguridad de los participantes y la integridad de los datos.
Enfrentamos desafíos y anticipamos el futuro de las BPC con un compromiso inquebrantable con la mejora continua y la adaptación a las nuevas tendencias y tecnologías.
En Cercal Group, nos especializamos en implementar y cumplir con las BPC, asegurando que cada proyecto que emprendemos cumpla con los más altos estándares éticos y científicos. Con aseguramiento de calidad, documentos del estudio y calidad de vida.
Las Buenas Prácticas Clínicas son la esencia de nuestro compromiso con la excelencia en la investigación clínica. En Cercal Group, vivimos y respiramos la práctica clínica cada día, esforzándonos por avanzar en la ciencia médica de manera ética y confiable.
Las BPC no son solo un estándar para nosotros; son una promesa a nuestra comunidad y a nosotros mismos.





One thought on “Comprendiendo a Fondo las Buenas Prácticas Clínicas en Investigación”
EXCELENTEB RESUMEN Y PROYECCION AL FUTURO DE LAS BPC