Contenidos en este artículo
La calificación de equipos críticos es un aspecto fundamental en la industria farmacéutica, caracterizada por su riguroso enfoque de análisis en la calidad del producto y seguridad de los productos que fabrica. Este proceso es esencial para asegurar la calidad de los medicamentos, ya que se utilizan en la producción con confiabilidad de los procesos.
En este artículo, explicaremos los pasos clave y los requisitos esenciales para llevar a cabo una calificación adecuada de equipos críticos. Desde la calificación de diseño hasta la calificación del desempeño y confiabilidad operacional. Revisaremos los aspectos fundamentales que deben tenerse en cuenta en este proceso, enfatizando la importancia de la calificación de equipos críticos en la industria farmacéutica.
“Un riguroso proceso de calificación de diseño asegura que los equipos cumplan con todas las especificaciones necesarias para su funcionamiento óptimo.”
Raúl Quevedo
COO Cercal Group
Importancia de la calificación de equipos críticos en la industria farmacéutica
La calificación de equipos críticos es un componente vital en la gestión de calidad de la industria farmacéutica. Los sistemas críticos, como cámaras frías, sistemas de aire comprimido y generadores de vapor puro, desempeñan un papel crucial en la fabricación de medicamentos. La calificación de equipos garantiza que estos sistemas cumplan con los estándares y requisitos establecidos, asegurando así la calidad y la integridad de los productos farmacéuticos.
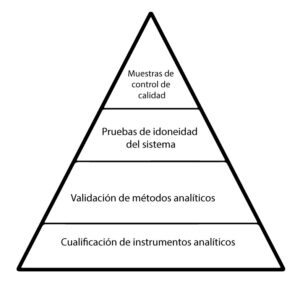
El capítulo 〈1058〉 ANALYTICAL INSTRUMENT QUALIFICATION de la USP (United States Pharmacopeia). Proporciona una guía detallada sobre la calificación de equipos analíticos, un componente esencial de la calificación de equipos críticos. Este capítulo destaca la importancia del proceso de validación del software, la calibración y el mantenimiento en el proceso de calificación. Siendo la validación del proceso de software especialmente relevante en el contexto de los equipos modernos, que a menudo dependen en gran medida del software para su funcionamiento.
De este modo, la calificación de equipos críticos no es un evento único, sino un proceso continuo que debe realizarse a lo largo de la vida útil del equipo. Esto incluye la calificación inicial del equipo, así como la re-calificación periódica para asegurar que el equipo sigue cumpliendo con los estándares requeridos. Además, cualquier cambio en el equipo o en su uso puede requerir una re-calificación.
La calificación es esencial para garantizar la seguridad del paciente. Un equipo mal calificado puede dar lugar a productos de calidad inferior, lo que puede poner en riesgo la salud del paciente. Por lo tanto, es una parte esencial de las buenas prácticas de fabricación (GMP) en la industria farmacéutica.
De este modo, la calificación de equipos críticos es un componente esencial de la gestión de calidad en la industria farmacéutica. Asegura que los equipos utilizados en la fabricación de medicamentos cumplen con los estándares requeridos, lo que a su vez garantiza la calidad y la seguridad de los productos farmacéuticos.
Pasos clave para la calificación de equipos críticos
Calificación de diseño
El primer paso en la calificación de equipos críticos es evaluar el diseño del equipo. Esto implica revisar las especificaciones técnicas, documentación y planos del fabricante para asegurarse de que el equipo cumple con los requisitos necesarios. Los protocolos de calificación de diseño deben establecer claramente los criterios de aceptación y los atributos de calidad que se deben evaluar.
Calificación de instalación
Una vez que el equipo ha sido diseñado y fabricado, se procede a su instalación en la planta de producción. En este paso, se verifica que la instalación se haya realizado correctamente y que todos los componentes estén en su lugar según las especificaciones. Se deben llevar a cabo pruebas de funcionamiento y se deben documentar los resultados para su posterior análisis de riesgo.
Calificación de equipos críticos de operación
La calificación de operación implica probar y verificar el rendimiento del equipo bajo condiciones normales de funcionamiento. Se deben seguir los protocolos de calificación de operación establecidos para evaluar el rendimiento del equipo y su capacidad para realizar las tareas requeridas. Se deben documentar los resultados y compararlos con los criterios de aceptación definidos previamente.
Calificación del desempeño
La calificación del desempeño se centra en evaluar el rendimiento del equipo en condiciones más exigentes. Se realizan pruebas y se registran los datos para evaluar la capacidad del equipo de mantener su rendimiento dentro de los límites establecidos. La calificación del desempeño es crucial para asegurar que el equipo pueda funcionar de manera confiable y consistente durante su ciclo de vida útil.
Requisitos esenciales para la calificación de equipos críticos
“La calificación de equipos críticos es esencial para garantizar la eficacia y seguridad en la producción farmacéutica.”
Claudia Velasco
CEO Cercal Group
Normas de seguridad
La calificación de equipos críticos debe cumplir con las normas de seguridad aplicables a la industria farmacéutica. Estas normas, como las Buenas Prácticas de Manufactura (GMP, por sus siglas en inglés) y las directrices de la Agencia Reguladora de Medicamentos y Productos Sanitarios (FDA, por sus siglas en inglés), establecen los estándares y requisitos mínimos para garantizar la calidad y seguridad de los productos farmacéuticos.
Mantenimiento preventivo en la calificación de equipos críticos
El mantenimiento preventivo es un aspecto crucial en la calificación de equipos críticos. Se deben establecer programas de mantenimiento regulares para garantizar que los equipos funcionen de manera óptima y cumplan con los estándares de calidad. El mantenimiento preventivo incluye inspecciones periódicas, limpieza, lubricación y calibración de los equipos, entre otras actividades.
Criterios de aceptación en la calificación de equipos críticos
Los criterios de aceptación son los estándares establecidos para determinar si un equipo cumple con los requisitos necesarios. Estos criterios deben ser claros y específicos, y se basan en los atributos de calidad definidos previamente. Los resultados de las pruebas y evaluaciones deben compararse con estos criterios para determinar si el equipo es aceptable o si se requieren acciones correctivas.
Calificación previa y protocolos de calificación
La calificación previa implica evaluar los equipos antes de su instalación en la planta de producción. Esto incluye la revisión de la documentación del fabricante, la realización de inspecciones visuales y la verificación de las especificaciones técnicas. Los protocolos de calificación establecen los procedimientos detallados que deben seguirse durante la calificación de equipos críticos. Incluyendo las pruebas, mediciones y registros necesarios para la confiabilidad del proceso.
Actividades de validación y gestión de calidad
La calificación de equipos críticos es parte integral de las actividades de validación en la industria farmacéutica. La validación del proceso que verifica y documenta de manera sistemática que un sistema, proceso o equipo cumple con los requisitos establecidos para la frecuencia de falla. La gestión de calidad se encarga de supervisar y garantizar la implementación adecuada de la calificación de equipos y otras actividades del proceso de validación en toda la planta de producción.
Gabinetes de bioseguridad: Calificación de equipos críticos para entornos seguros
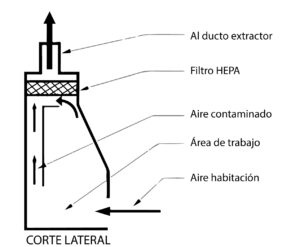
Los gabinetes de bioseguridad son sistemas críticos utilizados en la industria farmacéutica para proteger tanto al personal como al producto de posibles contaminaciones. Estos sistemas requieren una calificación de equipos críticos exhaustiva para garantizar su correcto funcionamiento y cumplimiento de los estándares de seguridad. A continuación, explicaremos los pasos clave y los requisitos esenciales en la calificación de gabinetes de bioseguridad.
Calificación de diseño de gabinetes de bioseguridad
La calificación de diseño es el primer paso en la calificación de gabinetes de bioseguridad. En esta etapa, se revisa y evalúa el diseño del gabinete, incluyendo la estructura, los sistemas de filtración, la circulación del aire y los controles de seguridad. Se deben establecer criterios de aceptación claros y específicos para asegurar que el diseño del gabinete cumple con los requisitos de bioseguridad.
Calificación de equipos críticos previa a la instalación
Antes de la instalación del gabinete de bioseguridad, es crucial llevar a cabo una calificación previa. Esto implica la revisión de la documentación del fabricante, la verificación de las especificaciones técnicas y la realización de inspecciones visuales. Además, se deben evaluar los criterios de aceptación establecidos durante la calificación de diseño para confirmar que el gabinete cumple con los requisitos previamente definidos.
Calificación de operación y desempeño
La calificación de operación se centra en probar y verificar el funcionamiento del gabinete de bioseguridad bajo condiciones normales de operación. Se deben seguir protocolos de calificación de operación establecidos, los cuales incluyen pruebas de rendimiento, verificación de los sistemas computarizados de filtración y evaluación de los controles de seguridad. Los resultados de estas pruebas deben cumplir con los criterios de aceptación definidos previamente.
La calificación del desempeño es una etapa adicional que evalúa el rendimiento del gabinete de bioseguridad en condiciones más exigentes. Se realizan pruebas de desafío para la confiabilidad del diseño, como la simulación de fugas o la exposición a agentes contaminantes controlados, para evaluar la capacidad del gabinete de mantener un ambiente seguro. Los resultados de estas pruebas deben cumplir con los criterios de aceptación establecidos y demostrar la eficiencia del gabinete en la protección contra contaminaciones.
Mantenimiento preventivo y calificación continua
El mantenimiento preventivo es esencial para garantizar el funcionamiento óptimo y la integridad del gabinete de bioseguridad. Se deben establecer programas de mantenimiento regulares que incluyan limpieza, calibración, reemplazo de filtros y verificación de los controles de seguridad. El mantenimiento preventivo ayuda a prevenir las consecuencias de fallas en la curva de confiabilidad. Y asegura que el gabinete cumpla con los estándares de seguridad durante su uso continuo.
Cabinas de flujo unidireccional: Garantizando la calidad en la gestión de la producción
Las cabinas de flujo unidireccional son equipos esenciales en la industria farmacéutica que proporcionan un ambiente estéril y controlado para la manipulación de productos sensibles. La calificación de equipos críticos adecuada de estas cabinas es crucial para asegurar la calidad de los productos y proteger la integridad del personal. En este apartado, explicaremos los protocolos de calificación, curvas de confiabilidad, atributos de calidad y actividades de validación. Necesarios para garantizar un funcionamiento óptimo de las cabinas de flujo unidireccional en una planta de producción.
El “Protocolo de Evaluación de Cabinas de Seguridad Biológicas” del Instituto de Salud Pública de Chile proporciona una guía detallada para la calificación de estas cabinas. Este protocolo incluye aspectos como el objetivo y el alcance de la evaluación, el marco legal, el desarrollo del protocolo y el contenido mínimo que debe tener un informe de evaluación.
La calificación de las cabinas de flujo unidireccional implica una serie de pasos, incluyendo la verificación de que la cabina cumple con las especificaciones de diseño, la comprobación de que está correctamente instalada y la validación de su rendimiento. También se deben realizar pruebas periódicas de catálogos de fallas. Para asegurar que la cabina sigue funcionando correctamente en confiabilidad de equipos.
Además, el protocolo destaca la importancia de mantener una documentación adecuada durante todo el proceso de análisis de confiabilidad humana. Esta documentación debe incluir detalles sobre la calificación inicial del equipo, cualquier cambio en el equipo o en su uso, y los resultados de las pruebas periódicas.
En resumen, la calificación de las cabinas de flujo unidireccional es un componente esencial de la gestión de la calidad en la industria farmacéutica. Siguiendo el “Protocolo de Evaluación de Cabinas de Seguridad Biológicas”, las empresas pueden asegurar que estas cabinas proporcionan un ambiente estéril y controlado para la manipulación de productos sensibles, protegiendo así la calidad de los productos y la integridad del personal.
Protocolos de calificación para cabinas de flujo unidireccional
Los protocolos de calificación son guías detalladas que describen los procedimientos y criterios a seguir durante el proceso de validación de las cabinas de flujo unidireccional. Estos protocolos deben ser establecidos y seguidos de acuerdo con las normas de la industria y las regulaciones aplicables. Los protocolos deben incluir pruebas específicas para evaluar el rendimiento de las cabinas y catálogo de fallas. Como la velocidad del flujo de aire, la uniformidad y la integridad del filtro.
Atributos de calidad en las cabinas de flujo unidireccional
Los atributos de calidad son características fundamentales que deben cumplirse para garantizar el correcto funcionamiento de las cabinas de flujo unidireccional. Algunos de estos atributos incluyen la velocidad del flujo de aire controlada, la ausencia de turbulencias, la eficiencia de los filtros y la integridad de la cabina. Estos atributos deben ser evaluados y registrados durante las pruebas en las etapas de calificación de equipos críticos. Para asegurar que se cumplan los estándares de calidad requeridos y datos de fallas para el costo de la falla Impacto.
Gestión de calidad y actividades de validación
La gestión de calidad desempeña un papel fundamental en la calificación de las cabinas de flujo unidireccional. Esto implica establecer un sistema de gestión que garantice que todas las actividades relacionadas con las cabinas se realicen de manera adecuada y cumplan con las normas y regulaciones aplicables. Las actividades de validación son parte integral de la gestión de calidad y abarcan desde la calificación inicial de las cabinas hasta las evaluaciones periódicas y el historial de mantenimiento preventivo alta criticidad.
Validación en la planta de producción
La validación de las cabinas de flujo unidireccional en la planta de producción es esencial para asegurar que cumplan con los requisitos establecidos. Esto implica la realización de pruebas de rendimiento y la verificación de los atributos de calidad antes de que las cabinas se pongan en funcionamiento. Además, se deben establecer programas de acciones de mantenimiento preventivo equipment for defects de baja confiabilidad. Y monitoreo continuo para garantizar un rendimiento óptimo a lo largo del tiempo.
Equipos críticos en la industria farmacéutica: Garantizando la calidad y la seguridad
La industria farmacéutica se basa en la producción de medicamentos y productos relacionados que requieren un riguroso control de calidad y seguridad. Para lograr esto, se utilizan una variedad de equipos críticos que desempeñan un papel fundamental en diferentes etapas del proceso de producción.
Exploramos una amplia gama de equipos críticos utilizados en la industria farmacéutica y discutiremos su importancia para garantizar la calidad y la seguridad de los productos farmacéuticos, durante la calificación de equipos críticos.
-
Autoclaves de vapor
Los autoclaves de vapor son equipos esenciales en la industria farmacéutica para la esterilización de equipos, materiales y productos. Utilizando altas temperaturas y presión de vapor, los autoclaves eliminan microorganismos y garantizan la esterilidad de los elementos utilizados en la producción y en los laboratorios farmacéuticos.
-
Autoclaves ETO
Los autoclaves ETO (óxido de etileno) son utilizados para la esterilización de productos farmacéuticos y dispositivos médicos sensibles al calor y la humedad. El óxido de etileno es un gas que penetra en el material y mata los microorganismos, siendo una opción eficaz para productos que no pueden ser esterilizados con calor húmedo.
-
Refrigeradores y freezers-congeladores
Los refrigeradores y freezers-congeladores son equipos críticos para el almacenamiento seguro de productos farmacéuticos, como medicamentos y muestras sensibles a la temperatura. Estos equipos proporcionan condiciones controladas de temperatura para preservar la estabilidad y la eficacia de los productos para la confiabilidad del equipo.
-
Ultrafreezers
Los ultrafreezers son utilizados para el almacenamiento a bajas temperaturas, generalmente por debajo de -80 °C. Estos equipos son esenciales para la conservación de muestras biológicas, reactivos y productos farmacéuticos que requieren temperaturas extremadamente bajas para su estabilidad y viabilidad.
-
Hornos de despirogenización
Los hornos de despirogenización se utilizan para eliminar las endotoxinas (pirógenos) de los equipos y recipientes utilizados en la producción farmacéutica. Las endotoxinas son sustancias derivadas de bacterias que pueden causar reacciones adversas en el cuerpo humano. Los hornos de despirogenización garantizan la eliminación efectiva de estas sustancias, asegurando la calidad y la seguridad de los productos farmacéuticos.
-
Colectores de polvo
Los colectores de polvo son equipos utilizados para capturar y filtrar partículas finas y polvo en el aire. En la industria farmacéutica, estos equipos son fundamentales para mantener un entorno de trabajo limpio y libre de contaminantes, evitando la dispersión de partículas que podrían afectar la calidad de los productos.
-
Campanas de extracción
Las campanas de extracción son sistemas de ventilación diseñados para eliminar gases, vapores y sustancias químicas peligrosas del área de trabajo. En los laboratorios farmacéuticos equipo crítico. Estas campanas son esenciales para garantizar la seguridad del personal al manipular productos químicos y sustancias tóxicas, evitando su exposición y minimizando el nivel de criticidad y de riesgo de contaminación.
-
Instrumentos y equipos de laboratorio
Los instrumentos y equipos de laboratorio son una parte integral de la industria farmacéutica, utilizados para llevar a cabo pruebas, análisis de riesgo y experimentos en el desarrollo y control de calidad de los productos farmacéuticos. Estos equipos incluyen espectrofotómetros, cromatógrafos, balanzas, microscopios, entre otros, y desempeñan un papel crucial en la obtención de resultados precisos y confiables.
-
Equipos de producción
Los equipos de producción en la industria farmacéutica incluyen mezcladoras, encapsuladoras, llenadoras, prensas de tabletas, entre otros. Estos equipos son esenciales para la fabricación y el envasado de medicamentos y productos farmacéuticos, asegurando la precisión, eficiencia y calidad del listado de procesos de producción.
Conclusión – Calificación de equipos críticos
La calificación de equipos críticos en la industria farmacéutica es una tarea fundamental para garantizar la calidad, seguridad y eficacia de los productos fabricados. Los equipos críticos, como los gabinetes de bioseguridad, las cabinas de flujo unidireccional, los autoclaves, los refrigeradores, los ultrafreezers y otros, deben ser calificados de acuerdo con los criterios de aceptación establecidos en los protocolos de calificación y los atributos de calidad definidos en la gestión de calidad.
Donde la calificación de equipos consta de tres etapas principales: calificación de diseño, calificación de operación y calificación de desempeño. Cada una de estas etapas tiene su propio conjunto de requisitos y pruebas que deben ser cumplidos antes de que un equipo pueda ser utilizado en la planta de producción. Además, la calificación previa de equipos y la realización del plan de mantenimiento preventivo son esenciales para garantizar un ciclo de vida prolongado y un rendimiento óptimo de los equipos.
En Cercal Group, nos enfocamos en ofrecer soluciones prácticas, innovadoras, ágiles y con los más altos estándares de calidad para cumplir con las exigencias regulatorias en la industria farmacéutica. Ofrecemos una amplia gama de servicios de calificación de equipos, incluyendo la calificación de equipos críticos, análisis del riesgo, calificación de sistemas, catál y un listado de procesos. Para ayudar a las empresas farmacéuticas a cumplir con las normas de seguridad y calidad requeridas por las autoridades sanitarias regulatorias.ina
Si necesitas más información sobre nuestros servicios de calificación de equipos o desea solicitar una cotización, no dudes en ponerte en contacto con nosotros. Estaremos encantados de ayudarte en todo lo que necesites.