Contenidos en este artículo
El Informe 37 de la OMS es un documento crucial en la industria farmacéutica, estableciendo directrices para la gestión de calidad y la fabricación de productos. Este informe aborda aspectos críticos y relacionados con la producción y distribución de productos farmacéuticos.
Resalta la importancia de prácticas de fabricación rigurosas, asegurando que cada producto acabado cumpla con los estándares internacionales. Además, enfatiza la gestión del riesgo en cada etapa, desde la obtención de sustancias farmacéuticas hasta la entrega al consumidor.
Los elementos esenciales delineados en el Informe 37 de la OMS guían a la industria farmacéutica global, promoviendo la seguridad, eficacia y calidad en la fabricación de productos farmacéuticos.
Claudia Velasco
CEO Cercal Group
“El Informe 37 de la OMS comienza a exigir que el personal especialista esté adecuadamente calificado y preparado.”
Armonización Global y Calidad Farmacéutica en la Era del Informe 37
La armonización global y la calidad farmacéutica han experimentado un cambio significativo con la introducción del Informe 37 de la OMS. Este documento esencial ha sido un catalizador en la estandarización de las Buenas Prácticas de Manufactura (BPM), estableciendo un marco normativo que trasciende fronteras nacionales.
Su influencia se extiende a la calidad y seguridad de los productos farmacéuticos, enfatizando la importancia de procesos de manufactura consistentes y controlados en todo el mundo.
El Informe 37 no solo ha unificado criterios de calidad, sino que también ha fomentado una colaboración internacional más estrecha. Las agencias reguladoras de diferentes países ahora trabajan conjuntamente para alinear sus políticas y procedimientos, lo que facilita el comercio internacional de productos farmacéuticos y asegura que los estándares de calidad y seguridad sean uniformes a nivel global.
Esta armonización es crucial para proteger la salud pública, permitiendo un acceso más rápido y seguro a medicamentos esenciales en todas las regiones.
Además, el Informe 37 ha impulsado la innovación en la industria farmacéutica. Al proporcionar directrices claras y detalladas, ha establecido un terreno fértil para el desarrollo de nuevas tecnologías y procesos de manufactura.
Las empresas farmacéuticas están ahora más equipadas para adaptarse a las cambiantes demandas del mercado y a las expectativas regulatorias, manteniendo al mismo tiempo la integridad y la eficacia de sus productos.
El Informe 37 ha sido un hito en la industria farmacéutica, promoviendo la armonización global, asegurando la calidad farmacéutica y fomentando un entorno de colaboración y mejora continua.
Su impacto se refleja en cada aspecto de la fabricación y distribución de productos farmacéuticos, estableciendo un estándar de excelencia y confianza en la atención sanitaria a nivel mundial.
El Origen y Propósito del Informe 37 de la OMS

El Informe 37 de la OMS establece un marco normativo integral para la gestión de productos farmacéuticos, enfatizando la calidad y seguridad desde el desarrollo hasta la comercialización del producto.
Este documento esencial guía a los fabricantes de productos en la implementación de prácticas rigurosas para asegurar que cada producto destinado al mercado cumpla con los más altos estándares.
La calidad del producto es primordial, y el informe detalla procesos específicos para mantener el control de productos en cada etapa de su ciclo de vida.
Aspectos clave incluidos en el informe
- Desarrollo del Producto: Establece las bases para la creación de productos farmacéuticos seguros y eficaces.
- Control de Productos: Enfatiza la importancia de monitorear cada lote del producto para garantizar su calidad y trazabilidad.
- Especificaciones de Productos: Define los estándares que cada producto farmacéutico debe cumplir antes de su distribución.
- Manejo de Defectos del Producto: Proporciona directrices para la identificación y corrección de cualquier problema, asegurando la seguridad del consumidor.
- Productos Estériles: Subraya los procedimientos especiales para garantizar la esterilidad y prevenir la contaminación.
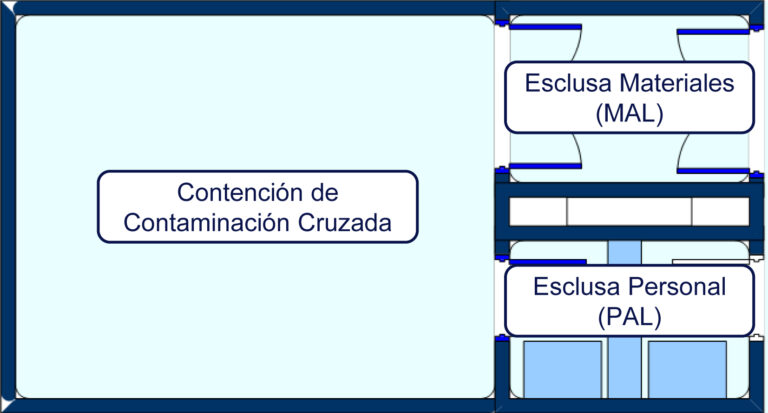
El informe también aborda la disposición de productos, asegurando que los productos exportados cumplan con las regulaciones internacionales y mantengan su integridad hasta llegar al consumidor final.
Los fabricantes de productos farmacéuticos deben adherirse a estas directrices para garantizar que cada producto farmacéutico no solo cumpla con las expectativas de calidad sino que también respete las normativas de seguridad y eficacia establecidas a nivel mundial.
El Informe 37 de la OMS es, por lo tanto, un recurso crucial para la industria farmacéutica, promoviendo la excelencia y la confianza en los productos farmacéuticos disponibles en el mercado global.
Impacto del Informe 37 en la Calificación del Personal y la Gestión de Riesgos en la Industria Farmacéutica
El Informe 37 de la OMS ha marcado un hito en la industria farmacéutica, especialmente en la calificación del personal y la gestión de riesgos. Este documento ha instaurado un marco normativo que enfatiza la calidad de los productos farmacéuticos y la competencia del personal.
La calificación del personal, según el Informe 37, trasciende la formación técnica e incluye la comprensión y aplicación de las Buenas Prácticas de Manufactura (BPM). Esto asegura que cada miembro del equipo contribuya efectivamente a la calidad y seguridad del producto.
La gestión de riesgos, otro aspecto crucial del Informe 37, ha llevado a las empresas a adoptar un enfoque proactivo. Este enfoque abarca:
- Identificación de riesgos en todos los niveles de producción.
- Evaluación exhaustiva de potenciales amenazas a la calidad del producto.
- Mitigación efectiva de riesgos para asegurar la seguridad del paciente.
Estas prácticas no se limitan a la producción, sino que se extienden a la cadena de suministro, la gestión de materiales y la distribución de productos. La implementación de sistemas de gestión de riesgos robustos permite a las organizaciones anticiparse a problemas, minimizando así el impacto en la calidad y la seguridad.
Además, el Informe 37 ha incentivado una cultura de mejora continua. Las organizaciones no solo están adoptando las directrices establecidas, sino que también están innovando en sus procesos y sistemas. Ejemplos de este compromiso incluyen:
- Formación continua del personal para mantenerse al día con las últimas prácticas y tecnologías.
- Revisión periódica de los sistemas de gestión de riesgos para adaptarse a los cambios del mercado y regulaciones.
Informe 37 de la OMS y su Marco Normativo
El Informe 37 de la OMS es un documento esencial que establece un marco normativo para la calificación y gestión de instalaciones, equipos y procesos en la industria farmacéutica.
Este marco garantiza que los productos farmacéuticos sean seguros, eficaces y de alta calidad.
Calificación de Instalaciones y Equipos
La calificación de instalaciones y equipos es un proceso crítico que asegura que todos los componentes funcionen según los requisitos previstos.
La calificación operacional y la calificación del desempeño son pasos esenciales para validar que los equipos no solo están instalados correctamente sino que también operan de manera consistente y reproducible dentro de los parámetros especificados.
Cronograma y Gestión de Calificación
El cronograma de calificación es fundamental para una gestión eficaz. Este programa detallado asegura que todas las actividades de calificación se realicen de manera oportuna y eficiente.
La función de gestión en este proceso es supervisar y coordinar todas las actividades, asegurando que se cumplan los estándares de calidad y las regulaciones pertinentes.
Calidad y Gestión de Control
La calidad y la gestión de control son aspectos cruciales del marco normativo del Informe 37 de la OMS.
Estos procesos garantizan que todos los aspectos de la fabricación y distribución de productos farmacéuticos se realicen de acuerdo con las directrices establecidas, minimizando los riesgos y asegurando la seguridad del producto.
El Informe 37 de la OMS, con su enfoque en la calificación de instalaciones, equipos y procesos, así como en la gestión eficaz de la calidad, proporciona un marco integral para asegurar que los productos farmacéuticos cumplan con los más altos estándares de seguridad y eficacia.
Informe 37 en la Salud Pública de Colombia
El Informe 37 de la OMS ha tenido un impacto significativo en la salud pública de Colombia, especialmente en la gestión y calidad de los medicamentos.
Este documento ha servido como una herramienta de gestión esencial para los laboratorios farmacéuticos, estableciendo estándares rigurosos para la elaboración de medicamentos y asegurando la calidad de los productos farmacéuticos.
Raúl Quevedo
COO Cercal Group
“El Informe 37, desde el punto de vista técnico, profundiza y aclara mucho más las GMP, establecidas en el informe 32”
Prácticas en el Laboratorio Farmacéutico
Las prácticas de laboratorio han sido transformadas por las directrices del Informe 37. Cada laboratorio fabricante ha adoptado procedimientos más rigurosos para garantizar la precisión y la calidad en el análisis de medicamentos.
Esto incluye desde la recepción de materias primas hasta el producto final.
Herramientas de Gestión y Calidad
El Informe 37 ha introducido herramientas de gestión avanzadas en el laboratorio farmacéutico, enfocándose en la mejora continua de la calidad de medicamentos.
Esto ha llevado a una mayor confianza en los medicamentos del laboratorio producidos en Colombia.
Elaboración y Análisis de Medicamentos
La elaboración de medicamentos se ha vuelto más sistemática y controlada, siguiendo las directrices establecidas para la calificación y validación de procesos.
El análisis de medicamentos se ha fortalecido, asegurando que cada producto cumpla con los estándares de calidad antes de su distribución.
- Calidad de Medicamentos: Asegurada a través de pruebas rigurosas y control de calidad.
- Maestro del Laboratorio: Documentación detallada y registros precisos para cada lote producido.
- Gestión Herramienta: Sistemas de gestión de calidad implementados para supervisar todos los procesos.
El Informe 37 de la OMS ha sido fundamental en elevar los estándares de calidad y seguridad en la industria farmacéutica de Colombia.
Asegurando que los medicamentos disponibles para la población cumplan con los más altos estándares internacionales.
Informe 37 de la OMS y la Respuesta Chilena
El Informe 37 de la OMS ha sido un documento clave en la industria farmacéutica, especialmente en Chile, donde las normativas 127, 139 y 147 han sido adoptadas para mejorar la calidad y seguridad de los medicamentos.
Este informe, en el contexto del vigésimo análisis de la OMS, ha proporcionado una base sólida para la validación de procesos y controles de proceso en la producción de medicamentos.
En Chile, el flujo del proceso en la fabricación de medicamentos ha sido meticulosamente revisado y ajustado para alinearse con las recomendaciones del informe. Esto ha asegurado que exclusivamente medicamentos que cumplen con los más altos estándares sean producidos y comercializados.
La atención al detalle en cada etapa del proceso de producción ha sido fundamental para garantizar la integridad y eficacia de los productos fabricados.
La implementación de estas normativas ha llevado a una revisión exhaustiva de los productos naturales y farmacéuticos en el país. Cada producto comercializado pasa por un riguroso proceso de validación, asegurando que los controles de proceso sean efectivos y consistentes.
La transparencia y la trazabilidad en la producción de medicamentos se han convertido en elementos esenciales, reflejando el compromiso de Chile con las directrices establecidas en el Informe 37 de la OMS.
La respuesta de Chile al Informe 37 de la OMS demuestra un compromiso firme con la calidad y seguridad en la industria farmacéutica. La adopción de estas normativas ha establecido un precedente para la producción de medicamentos en el país.
Asegurando que los productos comercializados cumplan con los estándares internacionales y satisfagan las necesidades de los pacientes de manera efectiva y segura.
México y el Informe 37 de la OMS
La migración del Informe 37 de la OMS hacia la práctica en México, especialmente bajo la normativa EN 059, ha marcado un cambio significativo en la industria farmacéutica.
Este proceso ha implicado una revisión exhaustiva de cómo los fabricantes de ingredientes y los productores de medicamentos abordan la calidad y la seguridad del ingrediente farmacéutico activo.
Los fabricantes de ingredientes ahora están más enfocados en garantizar la pureza y calidad del ingrediente activo. Esto ha llevado a un aumento en el análisis de pureza y en la rigurosidad de los análisis de contratos.
Cada documento de compra y cada contrato de prestación se examina minuciosamente para asegurar que los estándares del Informe 37 se cumplan en cada etapa.
En México, la industria farmacéutica ha tenido que adaptarse a estos nuevos estándares. Lo que ha resultado en una mejora significativa en la calidad de los productos farmacéuticos. Los siguientes puntos destacan los cambios clave:
- Revisión de Documentos: Cada documento obtenido en el proceso de fabricación se revisa para asegurar la conformidad con las normativas.
- Análisis Rigurosos: Los análisis de pureza y calidad son ahora más exhaustivos, garantizando la seguridad del producto final.
- Contratos Detallados: Los análisis de contratos deben reflejar los estándares del Informe 37, asegurando la calidad desde la adquisición de ingredientes hasta la fabricación.
Estos cambios han reforzado la posición de México en la industria farmacéutica global, asegurando que los productos fabricados en el país cumplan con los más altos estándares internacionales.
La adopción de la normativa EN 059, influenciada por el Informe 37 de la OMS, ha sido un paso crucial en este proceso, marcando un compromiso con la calidad y la seguridad en la fabricación de productos farmacéuticos.
Desafíos y Oportunidades
El correcto cumplimiento del Informe 37 de la OMS presenta tanto desafíos como oportunidades para la industria farmacéutica. Este documento establece estándares rigurosos para asegurar la calidad y seguridad de los productos farmacéuticos, desde los materiales de partida hasta el producto final.
La adherencia a estas directrices requiere una planificación meticulosa y un compromiso con la excelencia.
Uno de los desafíos más significativos es el cumplimiento del cronograma establecido para la implementación de las normativas. Las empresas deben asegurarse de que todos los aspectos relevantes del proceso de fabricación, incluyendo la adquisición de material de partida y el registro sanitario, cumplan con los plazos establecidos.
Esto requiere una coordinación eficiente y una gestión efectiva de los recursos.
Además, el registro de patente de nuevos productos farmacéuticos es un proceso complejo que debe alinearse con las directrices del Informe 37. Las empresas deben navegar por un entorno regulatorio que es tanto riguroso como en constante evolución, lo que puede presentar desafíos significativos.
Sin embargo, estos desafíos también presentan oportunidades. El cumplimiento riguroso de las normativas del Informe 37 puede mejorar la reputación de una empresa, aumentando la confianza de los consumidores y abriendo nuevas oportunidades de mercado.
Además, la adopción de estas directrices puede impulsar la innovación, ya que las empresas buscan desarrollar procesos de fabricación más eficientes y productos de mayor calidad.
A continuación, se presenta un cuadro que resume los desafíos y oportunidades:
| Desafíos | Oportunidades |
| Cumplimiento del cronograma | Mejora de la reputación y confianza |
| Registro de patente y sanitario | Acceso a nuevos mercados |
| Adquisición de material de partida | Impulso a la innovación y eficiencia |
El Informe 37 de la OMS establece un marco que, aunque desafiante. Ofrece numerosas oportunidades para que la industria farmacéutica mejore y se destaque en un mercado global competitivo.
Cercal Group: Facilitando la Implementación y Cumplimiento del Informe 37
En Cercal Group, nos dedicamos a asegurar que tu organización no solo entienda, sino que también aplique efectivamente las directrices del Informe 37 de la OMS.
Nuestro equipo de expertos se especializa en ofrecer soluciones integrales, abarcando desde la interpretación de normativas hasta su aplicación práctica en tus procesos de manufactura. Comprendemos que cada detalle es crucial en la industria farmacéutica, donde la calidad y la seguridad son primordiales.
Nuestros servicios están diseñados para apoyarte en cada paso del camino. Desde la calificación del personal hasta la gestión de riesgos y la implementación de Buenas Prácticas de Manufactura, nos aseguramos de que tu operación cumpla con los más altos estándares internacionales.
Con Cercal Group, obtienes un aliado comprometido con la excelencia y la mejora continua. Entendemos que la adaptación a las regulaciones globales puede ser un desafío. Por eso, nuestro enfoque se centra en proporcionar claridad y guía práctica.
Te ayudamos a navegar por las complejidades del Informe 37, asegurando que tu organización no solo cumpla con las expectativas regulatorias, sino que también las supere. Con Cercal Group, estás preparado para enfrentar auditorías y procesos regulatorios con confianza y eficacia.
Nuestra experiencia y conocimiento en la industria nos permiten ofrecer una perspectiva única y soluciones personalizadas. En Cercal Group, tu éxito es nuestra prioridad. Nos comprometemos a ser tu socio en la búsqueda de la excelencia operativa y regulatoria.
Conclusión
El Informe 37 de la OMS ha marcado un hito en la industria farmacéutica. Estableciendo estándares rigurosos para la calidad y seguridad de los ingredientes farmacéuticos. Este documento guía a los fabricantes de ingredientes en la producción de un ingrediente activo seguro y eficaz.
Enfatizando la importancia de un análisis de pureza meticuloso y un análisis de contratos detallado. Cada documento de compra y contrato de prestación es crucial, y su manejo adecuado es esencial para mantener la integridad de la cadena de suministro.
En este contexto, Cercal Group se posiciona como un aliado estratégico en la industria. Ofreciendo servicios que abarcan desde la fabricación por contrato hasta el almacenamiento adecuado de productos.
Nuestros servicios están diseñados para asegurar que cada paso del proceso. Desde la obtención del ingrediente farmacéutico hasta su almacenamiento. Cumpla con los estándares establecidos por el Informe 37 de la OMS.
Entendemos la importancia de cada documento obtenido y trabajamos para garantizar que la fabricación y el almacenamiento de productos sean impecables.
A través de nuestra colaboración con fabricantes y otros actores de la industria. Cercal Group contribuye a elevar los estándares de calidad y seguridad en la industria farmacéutica.
Nuestro compromiso con la excelencia y nuestro enfoque en soluciones integrales nos permiten no solo cumplir con las expectativas actuales. Sino también anticipar y prepararnos para los desafíos futuros.
Con el Informe 37 de la OMS como guía, trabajamos codo a codo con nuestros clientes. Para asegurar que la industria farmacéutica continúe avanzando hacia un futuro más seguro y confiable.


